Millikan-kísérlet és szimuláció
Szerkesztés alatt!
Tartalomjegyzék |
Elméleti összefoglaló
Történeti áttekintés
Elektromos jelenségekről először a görögök számoltak be, amikor feljegyezték, hogy a megdörzsölt borostyán a könnyű tárgyakat magához vonzza. E jelenséget 1747-ben Benjamin Franklin azzal magyarázta, hogy minden anyagban bizonyos mennyiségű elektromos folyadék vagy tűz található, mely folyadék többlete pozitív, hiánya eddig negatív töltést eredményez. Symmer tizenkét évvel későbbi elmélete szerint a semleges állapotban lévő anyag azért nem mutat elektromos tulajdonságokat, mert a pozitív ill. negatív elektromosságért felelős súlytalan folyadékokból azonos mennyiséget foglal magába.
Franklin már olyan elektromos részecske létezését tételezte fel, mely elegendően kicsi ahhoz, hogy könnyen behatoljon az anyagba. Kísérletei, melyek szerint elektrolízis közben az ellentétes elektródokon kiváló vegyületek tömege arányos kémiai egyenérték-súlyukkal, támogatták ezt a hipotézist. A folyadékelmélet és az az elképzelés, mely szerint az elektromosság az anyag mechanikai feszültségi állapota, a XIX. század végéig az elektromos jelenségek kizárólagos magyarázata maradt.
Az elektromosság azon természetes egységének megnevezésére, melynek hatására valamely elektródon egy atomnyi hidrogén vagy más egyértékűanyag szabadul fel, G. J. Stoney az “elektron” kifejezést javasolta 1891-ben.
Az egyszeres iontöltés meghatározását Townsend kísérelte meg először az 1890-es évek végén. Megfigyelte, hogy kénsav elektrolízise során pozitív töltésű hidrogén és oxigén szabadul fel. A felszabaduló ionizált gázt vízen átbuborékoltatva ködöt képzett. Feltételezte, hogy a telített vízgőzben minden ion nedvességet kondenzál maga körül, vagyis az ionok száma megegyezik a cseppekével.
Townsend eredményei a 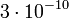 e.s.u. (e.s.u.:egykori elektrosztatikus egység) nagyságrendbe estek. J.J Thompson 1900-ban egy a Townsendéhez hasonló módszerrel
e.s.u. (e.s.u.:egykori elektrosztatikus egység) nagyságrendbe estek. J.J Thompson 1900-ban egy a Townsendéhez hasonló módszerrel 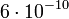 e.s.u. értéket kapott. Minthogy a feltevés, hogy cseppek egy iont tartalmaznak, csak közelítőleg bizonyult helyesnek, ezek a módszerek nem voltak alkalmasak az elektrontöltés pontos meghatározására.
e.s.u. értéket kapott. Minthogy a feltevés, hogy cseppek egy iont tartalmaznak, csak közelítőleg bizonyult helyesnek, ezek a módszerek nem voltak alkalmasak az elektrontöltés pontos meghatározására.
H.S. Wilson Townsend és Thompson kísérleteit úgy tökéletesítette, hogy a két lapos rézelektróda között állított elő ködöt. A töltetlen ill. 2000 V feszültségre kapcsolt lemezek között megfigyelve a ködcseppek esési sebességét, és kihasználva, hogy a két sebesség arányos a cseppekre ható erőkkel, Wilson meghatározta az elektron töltését, mely 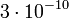 e.s.u értékűnek adódott. Mivel Wilson mérései a köd felső részére ill. a legkisebb töltésű cseppekre vonatkoztak (a nagyobb töltésű cseppek az elektromos térben gyorsabban mozogtak lefelé), eredményei összhangban voltak a cseppenkénti egy ion feltevéssel.
e.s.u értékűnek adódott. Mivel Wilson mérései a köd felső részére ill. a legkisebb töltésű cseppekre vonatkoztak (a nagyobb töltésű cseppek az elektromos térben gyorsabban mozogtak lefelé), eredményei összhangban voltak a cseppenkénti egy ion feltevéssel.
Millikan tovább javította Wilson elrendezését azzal, hogy a lemezekre nagyobb feszültséget kapcsolt, aminek következtében a cseppek esési sebessége nemcsak csök-kent, hanem esetenként meg is fordult. Egyes töltött cseppek felfelé mozogtak, mások gyorsan lefelé, míg a töltetlen cseppek változatlan sebességgel haladtak lefelé. Néhány csepp, amely akkora töltést hordozott, hogy a gravitációs erőt a cseppre ható elektromos erő csaknem kiegyenlítette, a látómezőben maradt. A lemezekre kapcsolt feszültség változtatásával Millikan kiegyensúlyozta ezen cseppeket, ami lehetővé tette, hogy egyetlen cseppen végezzen méréseket. Ezzel a módszerrel tanulmányozta az egyes ionok tulajdonságait, és vizsgálta, hogy a különböző ionok azonos a töltést hordoznak-e.
Az elektron töltésének meghatározása
A részecskék által hordozott elektromos töltés meghatározható, ha ismert nagyságú elektromos térben mérjük a részecskére ható erőt. Bár a megfelelő elektromos tér előállítása viszonylag egyszerű, az egy vagy néhány többletelektront hordozó részecskékre ható erő igen kicsi. Például egy 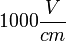 erősségű tér
erősségű tér 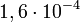 N erővel hat az egyetlen többlet elektronnal rendelkező részecskére, ami egy
N erővel hat az egyetlen többlet elektronnal rendelkező részecskére, ami egy 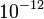 g tömegű részecskére ható gravitációs erővel mérhető össze.
Millikan kísérletének sikere attól függött, hogy tudnak-e ilyen nagyságrendű erőt mérni.
g tömegű részecskére ható gravitációs erővel mérhető össze.
Millikan kísérletének sikere attól függött, hogy tudnak-e ilyen nagyságrendű erőt mérni. 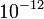 g vagy kisebb tömegű olajcseppek viselkedését vizsgálták gravitációs és elektromos térben. A levegőben eső csepp sebességének mérése a Stokes-törvény alkalmazásával lehetővé teszi a csepp tömegének meghatározását, míg az elektromos térben emelkedő csepp sebességéből a cseppre ható er őre, ill. a hordozott töltésre következtethetünk.
Bár ez a módszer lehetővé teszi egyetlen csepp töltésének vizsgálatát, csak a mért adatok elemzésével és némi kísérleti jártassággal lehetünk képesek egyetlen elektron töltésének meghatározására. A lassan eső vagy emelkedő cseppek csak kisszámú többlet elektront hordoznak. Mozgásuk megfigyelése alapján töltésük meghatározható,ami lehetővé teszi annak vizsgálatát, hogy a cseppek töltése egy elemi töltés egészszámú többszöröseként áll-e elő, ahogy azt az elektromos töltés kvantált természete alapján várjuk. Ha minden méréséhez más cseppet használunk, felmerül a kérdés, hogy milyen hatással van a töltésre maga a csepp. Ez a bizonytalanság kiküszöbölhet ő, ha ionizáló forrás alkalmazásával egyazon csepp töltését változtatjuk a megfigyelés során. Ha az eredményül kapott töltések valamely érték egészszámú többszörösei, akkor az elemi elektromos töltés létezését egyértelműen bizonyítottuk.
Az elektron töltésének ismeretében lehetőség nyílik az Avogadro-szám meghatározására is. Elektrolízis során az egy mólnyi mennyiség leválasztásához szükséges töltés (Faraday) egyenlő az elektron töltés és az Avogadro-szám szorzatával. Az elektrolízis kísérletekből adódóan
g vagy kisebb tömegű olajcseppek viselkedését vizsgálták gravitációs és elektromos térben. A levegőben eső csepp sebességének mérése a Stokes-törvény alkalmazásával lehetővé teszi a csepp tömegének meghatározását, míg az elektromos térben emelkedő csepp sebességéből a cseppre ható er őre, ill. a hordozott töltésre következtethetünk.
Bár ez a módszer lehetővé teszi egyetlen csepp töltésének vizsgálatát, csak a mért adatok elemzésével és némi kísérleti jártassággal lehetünk képesek egyetlen elektron töltésének meghatározására. A lassan eső vagy emelkedő cseppek csak kisszámú többlet elektront hordoznak. Mozgásuk megfigyelése alapján töltésük meghatározható,ami lehetővé teszi annak vizsgálatát, hogy a cseppek töltése egy elemi töltés egészszámú többszöröseként áll-e elő, ahogy azt az elektromos töltés kvantált természete alapján várjuk. Ha minden méréséhez más cseppet használunk, felmerül a kérdés, hogy milyen hatással van a töltésre maga a csepp. Ez a bizonytalanság kiküszöbölhet ő, ha ionizáló forrás alkalmazásával egyazon csepp töltését változtatjuk a megfigyelés során. Ha az eredményül kapott töltések valamely érték egészszámú többszörösei, akkor az elemi elektromos töltés létezését egyértelműen bizonyítottuk.
Az elektron töltésének ismeretében lehetőség nyílik az Avogadro-szám meghatározására is. Elektrolízis során az egy mólnyi mennyiség leválasztásához szükséges töltés (Faraday) egyenlő az elektron töltés és az Avogadro-szám szorzatával. Az elektrolízis kísérletekből adódóan 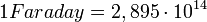 e.s.u., mely értéket az elektron töltésével (
e.s.u., mely értéket az elektron töltésével (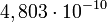 e.s.u.) osztva megkapjuk az Avogadro-számot.
e.s.u.) osztva megkapjuk az Avogadro-számot.
Egy csepp töltésének számítása
A csepp által hordozott töltés számításához vizsgáljuk meg, milyen erők hatnak egy olajcseppre. Az (1.ábra) az állandósult sebességgel eső cseppre ható erők láthatóak. (A kísérletben használt cseppek néhány 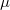 s alatt elérik végsebességüket.) Az (1.ábra)
s alatt elérik végsebességüket.) Az (1.ábra)  az esési sebesség,
az esési sebesség,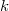 a súrlódási együttható a levegő és a csepp között,
a súrlódási együttható a levegő és a csepp között, 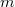 a csepp tömege és g a nehézségi gyorsulás. Mivel az erők egyenlők és ellentétes irányúak:
a csepp tömege és g a nehézségi gyorsulás. Mivel az erők egyenlők és ellentétes irányúak:
![\[ m g =k v_{f} \]](/images/math/0/8/9/089d66c99838f09c0cec47d1915f6238.png)
A (2.ábra) az elektromos tér hatására emelkedő cseppre ható erőket mutatja.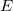 az elektromos térerősség,
az elektromos térerősség, 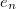 a csepp által hordozott töltés és
a csepp által hordozott töltés és 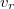 az emelkedés sebessége. Az erőket vektoriálisan összegezve:
az emelkedés sebessége. Az erőket vektoriálisan összegezve:
![\[E e_{n} = m g + k v_{f} \]](/images/math/b/9/7/b972c0df811628b6f0c9b798b6eb3b75.png)
Mivel a levegő sűrűsége csak mintegy ezredrésze az olajénak, a levegő felhajtóerejét elhanyagoltuk. Az (1) és (2) egyenletekből 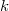 -t kiküszöbölve és
-t kiküszöbölve és 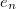 -re
megoldva:
-re
megoldva:
![\[ e_{n}=m g \frac{v_f+v_r}{E v_f} \]](/images/math/e/f/4/ef4b42c01590ddfad060199487fda3dc.png)
ahol
![\[ m = \frac{4}{3}\pi r^{3} \sigma \]](/images/math/2/a/d/2adb72b6d940dc3b6a71aa1afb95ae81.png)
míg r a csepp sugara, 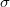 pedig az olaj sűrűsége. A csepp sugarát az
pedig az olaj sűrűsége. A csepp sugarát az 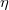 viszkozitású folyadékban eső gömb alakú test sugara és sebessége közötti kapcsolatot megadó Stokes-törvény alapján a
viszkozitású folyadékban eső gömb alakú test sugara és sebessége közötti kapcsolatot megadó Stokes-törvény alapján a
![\[r = \left[ \frac{9 \eta v_f}{2 g (\sigma - \rho)} \right] ^{1/2}\]](/images/math/8/c/6/8c68d732d35fc09e6e9f0884b4d9f2d2.png)
összefüggés szerint számítjuk, ahol 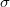 a közeg sűrűsége. A (4) és (5) egyenleteket (3) -ba helyettesítve és figyelembe véve, hogy az olaj sűrűsége sokkal nagyobb mint a levegőé (
a közeg sűrűsége. A (4) és (5) egyenleteket (3) -ba helyettesítve és figyelembe véve, hogy az olaj sűrűsége sokkal nagyobb mint a levegőé ( ):
):
![\[e_n = \left( \frac{4 \pi}{3}\right) \left[ \frac{\left( \frac{9 \eta}{2}\right)^{3}.}{g \sigma} \right] ^{1/2} \frac{\left(v_f+v_r\right)\left(v_f\right)^{1/2}.}{E}\]](/images/math/8/c/c/8cc037cb1d47cb1aaddeeaaafacebd50.png)
A Stokes-törvény azonban csak addig érvényes, míg a csepp sebessége nagyobb mint 0,1 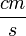 . (Az ilyen és kisebb sebességű cseppek 2
. (Az ilyen és kisebb sebességű cseppek 2 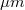 nagyságrendű átmérője összemérhető a levegő molekulák szabad úthosszával, amely esetben a Stokes-törvény érvényességének egyik alapfeltétele nem teljesül.) Mivel a cseppek tipikus sebessége kísérletünkben a 0,01 - 0,001
nagyságrendű átmérője összemérhető a levegő molekulák szabad úthosszával, amely esetben a Stokes-törvény érvényességének egyik alapfeltétele nem teljesül.) Mivel a cseppek tipikus sebessége kísérletünkben a 0,01 - 0,001 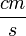 tartományba esik,egy
tartományba esik,egy
![\[ \left[ \frac{1}{1+\left( \frac{b}{pr}\right)}\right]^{3/2}\]](/images/math/5/1/2/512edd9b994a8fe8990ec9d08b018052.png)
alakú korrekciós tényező bevezetése szükséges, ahol 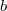 állandó,
állandó, 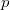 a légköri nyomás,
a légköri nyomás,  pedig a Stokes-törvényből számolt csepp sugár.
Az elektromos térerősség
pedig a Stokes-törvényből számolt csepp sugár.
Az elektromos térerősség 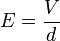 ahol
ahol 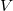 a
a 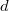 távolságban lévő párhuzamos lemezek közötti potenciálkülönbség. Ezt és (7)-et a (6) egyenletbe helyettesítve:
távolságban lévő párhuzamos lemezek közötti potenciálkülönbség. Ezt és (7)-et a (6) egyenletbe helyettesítve:
\[e_n = \left{ \left( \frac{4 \pi d}{3}\right) \left[ \frac{ \left(\frac{9 \eta}{2}\right)^{3}.}{g \sigma} \right] ^{1/2} \right} \times \left{ \left[ \frac{1}{1+\left( \frac{b}{p r}\right)}\right]^{3/2} \right} \times \left{ \frac{\left(v_f+v_r\right)v_f^{1/2}.}{E}\right}\]
Az első szorzófaktorban lévő mennyiségek állandók, a másodikban a csepp sugara, míg a harmadikban a mérendő sebességek szerepelnek. A fenti egyenletekben előforduló mennyiségek és mértékegységeik a következők:
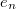 - a csepp által hordozott töltés
- a csepp által hordozott töltés 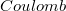 -ban,
-ban,
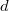 - a kondenzátor lemezei közötti távolság
- a kondenzátor lemezei közötti távolság 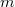 -ben,
-ben,
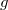 - a nehézségi gyorsulás
- a nehézségi gyorsulás 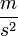 -ben,
-ben,
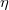 - a levegő viszkozitása
- a levegő viszkozitása 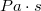 -ban,
-ban,
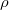 - a levegő sűrűsége
- a levegő sűrűsége 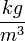 -ben,
-ben,
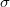 - az olaj sűrűsége
- az olaj sűrűsége 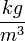 -ben,
-ben,
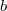 - állandó,
- állandó, 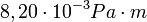 ,
,
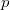 - a légköri nyomás
- a légköri nyomás 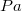 -ban,
-ban,
 - a csepp sugara
- a csepp sugara 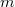 -ben,
-ben,
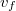 - az esési sebesség
- az esési sebesség 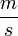 -ban,
-ban,
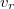 - az emelkedési sebesség
- az emelkedési sebesség 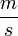 -ban,
-ban,
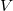 - a potenciálkülönbség a lemezek között
- a potenciálkülönbség a lemezek között 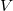 -ban.
-ban.
PDF formátum
Millikan-kísérlet és szimuláció(pdf)