„Fajhő mérése” változatai közötti eltérés
| 34. sor: | 34. sor: | ||
Egy anyag belső energiája ($U$) a rajta végzett makroszkopikus munka ($W$), vagy egy másik testtel létrejött kontaktus során molekuláris szinten lezajló energia átadás ($Q$) útján változtatható meg. Ezt a tapasztalatot rögzíti a hőtan I. főtétele: | Egy anyag belső energiája ($U$) a rajta végzett makroszkopikus munka ($W$), vagy egy másik testtel létrejött kontaktus során molekuláris szinten lezajló energia átadás ($Q$) útján változtatható meg. Ezt a tapasztalatot rögzíti a hőtan I. főtétele: | ||
| + | $$ \Delta U = \Delta Q + \Delta W $$ | ||
| + | ahol $\Delta U$ a belső energia megváltozása, $\Delta W$ a testen végzett makroszkopikus munka, $\Delta Q$ pedig a molekuláris mechanizmussal a testnek átadott energia, amit \textit{hőnek} (hőmennyiségnek) nevezünk. Ha egy testtel hőt közlünk (pl. elektromos fűtőtesttel melegítjük), akkor belső energiája és ezzel együtt hőmérséklete is megváltozik. A tapasztalat szerint nem túl nagy hőmennyiség közlése esetén a bekövetkező hőmérséklet-változás ($\Delta t$) egyenesen arányos a közölt hővel ($Q$), fordítottan arányos a vizsgált anyag tömegével ($m$) és függ a vizsgált anyag minőségétől is: | ||
| + | |||
| + | $$ \Delta t = \frac{Q}{cm} $$ | ||
</wlatex> | </wlatex> | ||
A lap 2012. augusztus 28., 17:47-kori változata
Szerkesztés alatt!
A mérés célja:
- elmélyíteni a hallgatók fajhővel kapcsolatos ismereteit,
- megismertetni a hallgatókat a fajhőmérés két módszerével.
Ennek érdekében:
- összefoglaljuk a fajhő mérésével kapcsolatos ismereteket, ismertetjük a keverési kaloriméterrel ill. az elektromos fűtésű kaloriméterrel történő fajhőmérést,
- a gyakorlat során megmérjük néhány anyag fajhőjét.
Tartalomjegyzék |
Elméleti összefoglaló
Egy anyag belső energiája (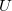 ) a rajta végzett makroszkopikus munka (
) a rajta végzett makroszkopikus munka (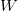 ), vagy egy másik testtel létrejött kontaktus során molekuláris szinten lezajló energia átadás (
), vagy egy másik testtel létrejött kontaktus során molekuláris szinten lezajló energia átadás (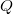 ) útján változtatható meg. Ezt a tapasztalatot rögzíti a hőtan I. főtétele:
) útján változtatható meg. Ezt a tapasztalatot rögzíti a hőtan I. főtétele:
![\[ \Delta U = \Delta Q + \Delta W \]](/images/math/2/7/f/27f7ad7ea1ba2b5b9574422f9502787f.png)
ahol 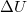 a belső energia megváltozása,
a belső energia megváltozása, 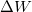 a testen végzett makroszkopikus munka,
a testen végzett makroszkopikus munka, 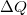 pedig a molekuláris mechanizmussal a testnek átadott energia, amit \textit{hőnek} (hőmennyiségnek) nevezünk. Ha egy testtel hőt közlünk (pl. elektromos fűtőtesttel melegítjük), akkor belső energiája és ezzel együtt hőmérséklete is megváltozik. A tapasztalat szerint nem túl nagy hőmennyiség közlése esetén a bekövetkező hőmérséklet-változás (
pedig a molekuláris mechanizmussal a testnek átadott energia, amit \textit{hőnek} (hőmennyiségnek) nevezünk. Ha egy testtel hőt közlünk (pl. elektromos fűtőtesttel melegítjük), akkor belső energiája és ezzel együtt hőmérséklete is megváltozik. A tapasztalat szerint nem túl nagy hőmennyiség közlése esetén a bekövetkező hőmérséklet-változás (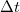 ) egyenesen arányos a közölt hővel (
) egyenesen arányos a közölt hővel (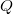 ), fordítottan arányos a vizsgált anyag tömegével (
), fordítottan arányos a vizsgált anyag tömegével (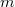 ) és függ a vizsgált anyag minőségétől is:
) és függ a vizsgált anyag minőségétől is:
![\[ \Delta t = \frac{Q}{cm} \]](/images/math/d/a/c/dac3f1f9b1083257be4bfc9306623ef2.png)