„Hőtani mérések 1-2.” változatai közötti eltérés
| 236. sor: | 236. sor: | ||
'''FIGYELEM!''' A második alkalomra az eddigi feladatok előzetes kiértékelését el kell végezni és meg kell mutatni a mérésvezetőnek. | '''FIGYELEM!''' A második alkalomra az eddigi feladatok előzetes kiértékelését el kell végezni és meg kell mutatni a mérésvezetőnek. | ||
| − | |||
'''FELADATOK MÁSODIK ALKALOMMAL''' | '''FELADATOK MÁSODIK ALKALOMMAL''' | ||
A lap 2021. szeptember 30., 15:54-kori változata
A mérés célja:
- elmélyíteni a hallgatók fajhővel kapcsolatos ismereteit,
- megismertetni a hallgatókat a fajhőmérés két módszerével.
Ennek érdekében:
- összefoglaljuk a fajhő mérésével kapcsolatos ismereteket, ismertetjük a keverési kaloriméterrel ill. az elektromos fűtésű kaloriméterrel történő fajhőmérést,
- a gyakorlat során megmérjük néhány anyag fajhőjét.
Tartalomjegyzék |
Elméleti összefoglaló
Egy anyag belső energiája (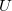 ) a rajta végzett makroszkopikus munka (
) a rajta végzett makroszkopikus munka (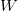 ), vagy egy másik testtel létrejött kontaktus során molekuláris szinten lezajló energia átadás (
), vagy egy másik testtel létrejött kontaktus során molekuláris szinten lezajló energia átadás (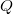 ) útján változtatható meg. Ezt a tapasztalatot rögzíti a hőtan I. főtétele:
) útján változtatható meg. Ezt a tapasztalatot rögzíti a hőtan I. főtétele:
![\[ \Delta U = \Delta Q + \Delta W \]](/images/math/2/7/f/27f7ad7ea1ba2b5b9574422f9502787f.png)
ahol 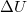 a belső energia megváltozása,
a belső energia megváltozása, 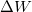 a testen végzett makroszkopikus munka,
a testen végzett makroszkopikus munka, 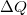 pedig a molekuláris mechanizmussal a testnek átadott energia, amit hőnek (hőmennyiségnek) nevezünk. Ha egy testtel hőt közlünk (pl. elektromos fűtőtesttel melegítjük), akkor belső energiája és ezzel együtt hőmérséklete is megváltozik. A tapasztalat szerint nem túl nagy hőmennyiség közlése esetén a bekövetkező hőmérséklet-változás (
pedig a molekuláris mechanizmussal a testnek átadott energia, amit hőnek (hőmennyiségnek) nevezünk. Ha egy testtel hőt közlünk (pl. elektromos fűtőtesttel melegítjük), akkor belső energiája és ezzel együtt hőmérséklete is megváltozik. A tapasztalat szerint nem túl nagy hőmennyiség közlése esetén a bekövetkező hőmérséklet-változás (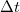 ) egyenesen arányos a közölt hővel (
) egyenesen arányos a közölt hővel (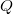 ), fordítottan arányos a vizsgált anyag tömegével (
), fordítottan arányos a vizsgált anyag tömegével (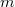 ) és függ a vizsgált anyag minőségétől is:
) és függ a vizsgált anyag minőségétől is:
![\[ \Delta t = \frac{Q}{cm} \]](/images/math/d/a/c/dac3f1f9b1083257be4bfc9306623ef2.png)
ahol az anyagra jellemző  állandót fajhőnek nevezzük. Számértéke megadja, hogy egységnyi tömegű anyaggal mennyi hőt kell közölnünk ahhoz, hogy hőmérsékletét 1 K-nel megváltoztassuk. Mértékegysége
állandót fajhőnek nevezzük. Számértéke megadja, hogy egységnyi tömegű anyaggal mennyi hőt kell közölnünk ahhoz, hogy hőmérsékletét 1 K-nel megváltoztassuk. Mértékegysége 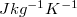 .
.
A testtel közölt hő azonban nemcsak a belső energia megváltoztatására, hanem munkavégzésre is fordítódhat:
![\[ \Delta Q = \Delta U - \Delta W \]](/images/math/1/3/6/13659aec3eb30ac8afa0da477615ebec.png)
Ennek megfelelően a fajhő:
![\[ c = \frac{1}{m} \frac{\Delta Q}{\Delta t} = \frac{1}{m} \frac{\Delta U}{\Delta t} - \frac{1}{m} \frac{\Delta W}{\Delta t} \]](/images/math/2/e/7/2e74705f7fc63f133db52e5666b153ec.png)
Mivel a munkavégzés függ a folyamat körülményeitől, a fajhő csak akkor határozható meg egyértelműen, ha a hőközlés folyamatát pontosan rögzítjük. Ennek megfelelően, elvileg igen sokféle fajhő definiálható, a gyakorlatban ezek közül kettőt használnak, az állandó térfogaton (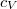 ) és az állandó nyomáson (
) és az állandó nyomáson (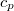 ) mért fajhőt. Gázok esetében e kétféle fajhő számottevően különböző, szilárd és folyékony anyagoknál közel azonos értékű.
) mért fajhőt. Gázok esetében e kétféle fajhő számottevően különböző, szilárd és folyékony anyagoknál közel azonos értékű.
A fajhő – különösen alacsony hőmérsékleten – a hőmérséklettől is függ. A mérés során szilárd anyagokat vizsgálunk amelyeknek fajhője a vizsgált hőmérsékleteken állandónak tekinthető és amelyeknél a 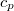 és
és 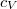 eltérése is elhanyagolható. Ezért a továbbiakban egyszerűen "fajhő"-ről beszélünk és az index nélküli
eltérése is elhanyagolható. Ezért a továbbiakban egyszerűen "fajhő"-ről beszélünk és az index nélküli  jelölést használunk. (Szigorúan véve
jelölést használunk. (Szigorúan véve 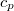 -t mérjük.)
-t mérjük.)
A mérnöki gyakorlatban a hűtő- és fűtő berendezések és határoló szerkezetek hőtani viselkedésének egyik meghatározója az alkalmazott anyagok fajhője. Az anyagtudományban a fajhő mérésével bizonyos anyagszerkezeti változásokat – fázisátalakulásokat – követhetünk nyomon. A fajhő meghatározása a 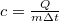 képlet alapján lehetséges. Megmérve a vizsgált anyag tömegét, az anyaggal közölt ill. a tőle elvont hő mennyiségét és a bekövetkezett hőmérséklet-változást, a fajhő kiszámítható.
képlet alapján lehetséges. Megmérve a vizsgált anyag tömegét, az anyaggal közölt ill. a tőle elvont hő mennyiségét és a bekövetkezett hőmérséklet-változást, a fajhő kiszámítható.
A gyakorlatban sok esetben közvetlenül a testtel közölt hő és a hőmérséklet-változás összefüggésére van szükség, így a fajhő helyett az adott testre jellemző 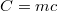 mennyiséget használják, amelyet hőkapacitásnak neveznek. A
mennyiséget használják, amelyet hőkapacitásnak neveznek. A 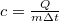 összefüggés így a
összefüggés így a 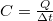 alakot ölti.
alakot ölti.
A vizsgált anyaggal történő hőközlés két módszere terjedt el, a különböző hőmérsékletű anyagok összekeverésével ill. az elektromos fűtőtesttel történő hőközlés. Az alábbiakban ezen két módszer alapgondolatát ismertetjük.
Fajhőmérés keveréssel
A mérendő  fajhőjű,
fajhőjű, 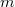 tömegű,
tömegű, 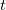 hőmérsékletű anyagot ismert paraméterekkel (
hőmérsékletű anyagot ismert paraméterekkel (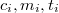 ) rendelkező anyaggal – általában olyan folyadékkal, amely nem lép kémiai reakcióba a mérendő anyaggal – összekeverjük, majd megmérjük a beálló közös hőmérsékletet (
) rendelkező anyaggal – általában olyan folyadékkal, amely nem lép kémiai reakcióba a mérendő anyaggal – összekeverjük, majd megmérjük a beálló közös hőmérsékletet (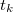 ). Feltéve, hogy a keverés során a két anyag között kizárólag hőátadás történik, a vizsgálandó anyag által felvett (vagy leadott) hő egyenlő az ismert anyag által felvett (vagy leadott) hővel, ezért
). Feltéve, hogy a keverés során a két anyag között kizárólag hőátadás történik, a vizsgálandó anyag által felvett (vagy leadott) hő egyenlő az ismert anyag által felvett (vagy leadott) hővel, ezért
![\[ c m ( t - t_k ) = c_i m_i ( t_k - t_i ) \]](/images/math/4/1/3/413b0e7bcec89bad57cd8e555aaa6052.png)
ami alapján az ismeretlen  fajhő meghatározható.
fajhő meghatározható.
Ez a módszer elsősorban szilárd testek és folyadékok fajhőjének meghatározására alkalmas, de segítségével gázok állandó nyomáson mért fajhője is megmérhető. Ebben az esetben a vizsgált gázt cső-spirálon áramoltatják a folyadékon át. A gáz tömegének, hőmérséklet-változásának valamint a mérő folyadék adatainak ismeretében a gáz állandó nyomáson mért fajhője (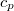 ) meghatározható. Az állandó nyomáson mért fajhő ismeretében az állandó térfogaton mért fajhő, (
) meghatározható. Az állandó nyomáson mért fajhő ismeretében az állandó térfogaton mért fajhő, (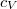 ) szintén meghatározható (pl. hangsebesség-méréssel).
) szintén meghatározható (pl. hangsebesség-méréssel).
Fajhőmérés elektromos energiaközléssel
Ennél a módszernél a vizsgált anyag (fajhője  , tömege
, tömege 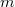 ) hőmérsékletét elektromos fűtőtest segítségével
) hőmérsékletét elektromos fűtőtest segítségével 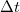 értékkel megnöveljük. Feltéve, hogy a fűtőtest által leadott energia teljes egészében a vizsgált anyag belső energiáját növeli:
értékkel megnöveljük. Feltéve, hogy a fűtőtest által leadott energia teljes egészében a vizsgált anyag belső energiáját növeli:
![\[ U I \tau = c m \Delta t \]](/images/math/e/a/4/ea447715765cb9f8f91c3f70d4c7b62f.png)
amiből az UI fűtőteljesítmény, a  melegítési idő, a vizsgált anyag
melegítési idő, a vizsgált anyag 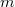 tömege és a
tömege és a 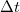 hőmérséklet-változás ismeretében a
hőmérséklet-változás ismeretében a  fajhő meghatározható.
fajhő meghatározható.
A módszer elsősorban folyadékok fajhőjének meghatározására alkalmas. Használható azonban szilárd anyagok esetén is, ha azokat folyadékba helyezve a folyadékkal együtt melegítjük.
A kaloriméter hőkapacitása és a hőmérsékleti korrekció
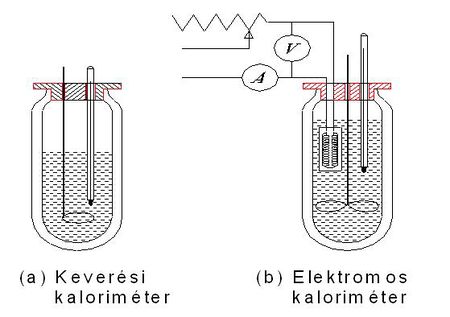
A keveréssel és az elektromos melegítéssel történő fajhőmérés esetén eddig feltételeztük, hogy a folyamat a környezettől hőtanilag jól elszigetelve, hőveszteség nélkül játszódik le. Ennek a feltételnek a teljesítése érdekében a hőközlés a környezettől jó hőszigetelő anyagokkal elválasztott edényben, kaloriméterben történik. (Egy keverési és egy elektromos kaloriméter vázlatát az 1. ábra mutatja.)
Ennek ellenére a hőveszteség nélküli mérés mégsem valósítható meg, elsősorban az alábbi két ok miatt: az egyik az, hogy az edény hőmérséklete is változik a mérés közben és ez is energiát igényel, a másik pedig, hogy bármilyen jó hőszigetelést is alkalmazunk a környezet felé mindig történik energiaátadás. Ez a két ok (hiba) a kaloriméter hőkapacitásának figyelembevételével illetve a hőveszteségek becslésével csökkenthető.
A kaloriméter hőkapacitása
Ha tudnánk azt, hogy a kaloriméter egyes részei milyen tömegűek, mekkora a fajhőjük és milyen mértékben melegszenek fel, akkor meg tudnánk határozni a kísérlet közben a kaloriméter egyes részeinek melegítéséhez szükséges energiát. Ez az eljárás gyakorlatilag megvalósíthatatlan. Ehelyett mérés segítségével meghatározzuk a kaloriméter 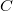 hőkapacitását. Ha a kaloriméter hőkapacitását is figyelembe vesszük, akkor a hőcserét leíró egyenleteink az alábbiak szerint módosulnak:
hőkapacitását. Ha a kaloriméter hőkapacitását is figyelembe vesszük, akkor a hőcserét leíró egyenleteink az alábbiak szerint módosulnak:
![\[ c m ( t - t_k ) = c_i m_i ( t_k - t_i ) + C ( t_k - t_i )\]](/images/math/c/f/5/cf598a2aa784520a46a17534ddcd6899.png)
![\[ U I \tau = c m \Delta t + C \Delta t. \]](/images/math/d/6/4/d64af22861d66fd1ceace71d63ee76ce.png)
A kaloriméter hőkapacitásának meghatározásához ismert fajhőjű (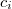 ,
,  ) anyagok alkalmazásával a fenti egyenletek valamelyikével történik. Ismert fajhőjű anyagként rendszerint vizet alkalmazunk.
) anyagok alkalmazásával a fenti egyenletek valamelyikével történik. Ismert fajhőjű anyagként rendszerint vizet alkalmazunk.
A hőmérsékleti korrekció
A kaloriméter belseje és a környezet között energiaátadást a belső tér (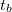 ) és a környezet (
) és a környezet (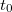 ) hőmérséklete közötti eltérés eredményezi. Az ezen hőmérséklet-különbség okozta energiaátadást jó hőszigeteléssel valamint egymáshoz közeli
) hőmérséklete közötti eltérés eredményezi. Az ezen hőmérséklet-különbség okozta energiaátadást jó hőszigeteléssel valamint egymáshoz közeli 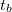 és
és 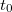 választással csökkentjük. A kaloriméter belseje és a külső tér között mindezek ellenére fellépő energiacsere "hőmérsékleti korrekcióval" vehető figyelembe. Az alábbiakban a hőmérsékleti korrekció grafikus végrehajtását mutatjuk be.
választással csökkentjük. A kaloriméter belseje és a külső tér között mindezek ellenére fellépő energiacsere "hőmérsékleti korrekcióval" vehető figyelembe. Az alábbiakban a hőmérsékleti korrekció grafikus végrehajtását mutatjuk be.
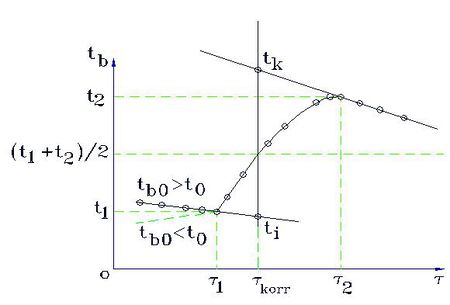
A 2. ábra a kaloriméteres mérés során a kaloriméter hőmérsékletének változását mutatja be az idő függvényében. A görbe három jól elkülöníthető szakaszra osztható, az egyes szakaszokon lejátszódó folyamatokat áttekintjük:
- Előperiódus: A kaloriméterbe helyezett folyadék (víz, olaj stb.) és a kaloriméter, valamint a folyadék és a környezet közötti hőmérsékleti egyensúly kialakulásának folyamata. A kaloriméter és a mérő folyadék hőmérsékletétől függően ebben a szakaszban a belső tér hőmérséklete csökken ha
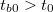 vagy növekszik ha
vagy növekszik ha 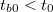 (
(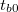 a belső tér hőmérséklete kísérlet indításakor). Ebben a szakaszban a kis hőmérséklet-különbségek miatt a hőmérséklet - idő kapcsolat jó közelítéssel lineárisnak tekinthető.
a belső tér hőmérséklete kísérlet indításakor). Ebben a szakaszban a kis hőmérséklet-különbségek miatt a hőmérséklet - idő kapcsolat jó közelítéssel lineárisnak tekinthető.
- Főperiódus: Az előperiódus a fő energiaátadási folyamattal folytatódik (főperiódus), amely az anyagok összekeveredésével illetve a fűtőtest bekapcsolásával kezdődik. A főperiódusban a belső tér hőmérséklete (
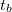 ) emelkedik. Ebben a szakaszban megy végbe az energiacsere az összekevert különböző hőmérsékletű anyagok között, vagy a kaloriméterben levő anyagok és a fűtőtest között. A kaloriméter belsejének hőmérséklete a környezeti hőmérséklet fölé emelkedik
) emelkedik. Ebben a szakaszban megy végbe az energiacsere az összekevert különböző hőmérsékletű anyagok között, vagy a kaloriméterben levő anyagok és a fűtőtest között. A kaloriméter belsejének hőmérséklete a környezeti hőmérséklet fölé emelkedik 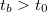 és ezért energialeadás történik a környezet felé. A hőveszteség miatt a belső tér hőmérséklete nem érheti el a tökéletes hőszigetelés esetén várható
és ezért energialeadás történik a környezet felé. A hőveszteség miatt a belső tér hőmérséklete nem érheti el a tökéletes hőszigetelés esetén várható 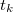 egyensúlyi hőmérsékletet. A főperiódust követő szakasz (az utóperiódus) hőmérséklet-idő grafikonjából azonban következtetni tudunk erre az értékre.
egyensúlyi hőmérsékletet. A főperiódust követő szakasz (az utóperiódus) hőmérséklet-idő grafikonjából azonban következtetni tudunk erre az értékre.
- Utóperiódus: Ebben a szakaszban
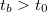 és a nem tökéletes hőszigetelés miatt lassan csökken a kaloriméter belsejében a hőmérséklet. A hőmérséklet-csökkenést most is lineárisnak tekintjük.
és a nem tökéletes hőszigetelés miatt lassan csökken a kaloriméter belsejében a hőmérséklet. A hőmérséklet-csökkenést most is lineárisnak tekintjük.
Látható, hogy a folyamat a nem tökéletes hőszigetelésből adódó hibák miatt az ideálistól eltérően alakul. A hőmérséklet - idő görbe felvétele azonban lehetőséget ad a hibák korrigálására. A hőmérsékleti korrekció gyakorlati végrehajtása a következőképpen történik (2. ábra). Felvesszük a kaloriméter hőmérsékletének időfüggvényét. Az elő- és utóperiódus szakaszára egyenest illesztünk. Tegyük fel, hogy az előperiódusra illesztett egyenes utolsó érintési pontjának koordinátái 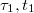 . Az utóperiódusra illesztett egyenes első érintkezési pontjának koordinátái
. Az utóperiódusra illesztett egyenes első érintkezési pontjának koordinátái 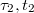 . Ezek megállapítása után megrajzoljuk a
. Ezek megállapítása után megrajzoljuk a 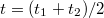 időtengellyel párhuzamos egyenest. Ennek az egyenesnek és a főperiódus görbéjének metszéspontján keresztül párhuzamost húzunk a hőmérséklettengellyel. Ez utóbbi egyenesnek és az időperiódusra illesztett egyenesnek a metszéspontját tekintjük a kaloriméter + mérőfolyadék rendszer kezdeti hőmérsékletének (
időtengellyel párhuzamos egyenest. Ennek az egyenesnek és a főperiódus görbéjének metszéspontján keresztül párhuzamost húzunk a hőmérséklettengellyel. Ez utóbbi egyenesnek és az időperiódusra illesztett egyenesnek a metszéspontját tekintjük a kaloriméter + mérőfolyadék rendszer kezdeti hőmérsékletének (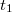 ), az utóperiódusra illesztett egyenessel való metszéspontját fogadjuk el közös hőmérsékletnek (
), az utóperiódusra illesztett egyenessel való metszéspontját fogadjuk el közös hőmérsékletnek (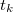 ).
).
A korrekció fenti módon történő végrehajtása az alábbiakon alapul: A környezettel való energiacsere miatt a kaloriméterben állandóan változik a hőmérséklet, egyensúlyi hőmérséklet sem alakulhat ki, így sem a kiindulási, sem a véghőmérsékletet nem tudjuk megmérni. Az előperiódusra fektetett egyenes mutatja, hogy hogyan változna a kaloriméter belsejében a hőmérséklet, ha nem indulna meg az energiacsere a főperiódusban. Ebből lehet a valódi kezdeti hőmérsékletre következtetni.
Az utóperiódusra fektetett egyenes segítségével arra lehet következtetni, hogy milyen hőmérséklet értéket vehetett volna fel a kaloriméter belseje ideális hőszigetelés mellett.
A jó minőségű kaloriméter hőkapacitása kicsi és hőszigetelése jó, azaz kicsi a környezettel való energiacsere. Ekkor a hőmérséklet közel állandó az elő- és utóperiódus során.
Oldódás vizsgálata
Oldódás során az oldószer és az oldott anyag részecskéi összekeverednek. Az oldódás sebessége függ az oldószer és az oldott anyag hőmérsékletétől, minőségétől, az oldódó anyag felületének nagyságától és az áramlást elősegítő keveréstől. A folyamat során az oldat felmelegedhet (exoterm oldódás) vagy lehűlhet (endoterm oldódás). Ezt az energiaváltozást a 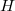 oldáshővel jellemezzük, aminek számértéke megmutatja, hogy mekkora hő szabadul fel (negatív érték) vagy mennyi hő vonódik el (pozitív érték) 1 mol anyag oldódásakor.
oldáshővel jellemezzük, aminek számértéke megmutatja, hogy mekkora hő szabadul fel (negatív érték) vagy mennyi hő vonódik el (pozitív érték) 1 mol anyag oldódásakor.
Az oldáshő meghatározását egy hétköznap is használatos vegyület, a kalcium-klorid oldáshőjének mérésével végezzük. A kalcium-klorid oldódás közben intenzíven hőt termel, ezért jégolvasztásra is alkalmazzák. Az utakra szórva hatékonyan felolvasztja a jégpáncélt, és oldott állapotban kevésbé káros a növényekre, mint a nátrium-klorid és alacsonyabb hőmérsékleten is használható. Ezen kívül vízmegkötésre is használják (pl. betonkeverékekben), emiatt fontos, hogy a sót jól záródó edényben kell tárolni.
A mérőeszköz
A méréshez használt eszközök:
- 2 db 0,75 l űrtartalmú duplafalú rozsdamentes termosz platina vékonyréteg ellenálláshőmérőkkel
- elektromos vízforraló
- 1,2
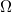 -os, 50 W maximális teljesítményű fűtőellenállás
-os, 50 W maximális teljesítményű fűtőellenállás
- Hameg multiméter számítógépes kezelőprogrammal
- tápegység a fűtőellenállás meghajtásához
- mérőhelyenként 1 db alumínium és 1 db sárgaréz próbatest, a próbatestek tömegei:
- A jelű alumínium tömb 594,5 g (± 0,2 g)
- B jelű alumínium tömb 533,2 g (± 0,2 g)
- C jelű sárgaréz tömb 1605 g (± 5 g)
- D jelű sárgaréz tömb 1600 g (± 5 g)
- Ellenőrizzük, hogy melyik próbatesten végezzük a mérést!
- jég
- mérőhenger
- 1 db kalibrált higanyszálas hőmérő
- mágneses keverő
- digitális mérleg
- tartó állvány a termoszokhoz
Az oldáshő méréséhez:
- edény zárófedővel és keverővel
- kalcium-klorid
- desztillált víz
- digitális hőmérő
- digitális mérleg
Mérési feladatok
A méréshez rendelkezésre álló eszközök
- A mérés elvégzéséhez és a mérési napló elkészítéséhez a dőlt betűs részekben adunk segítséget.
- Figyelem! A forró víz komoly égési sérüléseket okozhat, így a mérési gyakorlaton különös figyelmet és óvatosságot várunk el! Figyeljünk arra, hogy a forró víz ne ömöljön ki, ill. hogy a forró fém próbatesteket kézzel ne érintsük! A forróvizes termoszt mindig rögzítsük az erre szolgáló állvány segítségével, hogy véletlenül se tudjon kiborulni!
- A műanyag mérőhengerekbe sose töltsünk forró vizet, mert az a hengerek károsodásához vezet!
- A méréseknél használt vízmennyiségek pontosabb meghatározásához segítséget nyújtanak a rendelkezésre álló digitális mérlegek! Célszerű a mérés elején az üres termoszok tömegét meghatározni.
- A pontos fajhőmérés alapvető feltétele a termikus egyensúly kialakulása, melyet mágneses keverő segítségével jelentősen felgyorsíthatunk!
- A mágneses keverő közvetlen közelében elhelyezkedő hőmérővezetékekben a keverő jelentős zajt indukál, így a vezetékeket a keverőtől minél távolabb rögzítsük!
- A mérések közben értékeljük ki az eredményeket! Lehetőség szerint a 4-8. méréseket ismételjük meg. Ha jelentős eltérést tapasztalunk mérések között, illetve ha a mért értékek jelentősen eltérnek az irodalmi adatoktól, próbáljuk megtalálni, és kiküszöbölni a mérési hiba okát!
FELADATOK ELSŐ ALKALOMMAL
1. A hőmérők kalibrálása
A méréshez Pt 100-as szabvány vékonyréteg ellenálláshőmérőket használunk, melyek ellenállása 0 °C-on 100 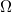 , és melegítés hatására lineárisan, 0,39
, és melegítés hatására lineárisan, 0,39 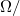 °C meredekséggel nő. A számítógépes mérőprogram ez alapján az összefüggés alapján számolja a hőmérsékletet. A hőmérőhöz vezető drótok, a banándugók és a forrasztás véges ellenállása miatt viszont megjelenik egy konstans (hőmérséklet-független) soros ellenállás, ami miatt a mért hőmérsékletérték korrekcióra szorul.
°C meredekséggel nő. A számítógépes mérőprogram ez alapján az összefüggés alapján számolja a hőmérsékletet. A hőmérőhöz vezető drótok, a banándugók és a forrasztás véges ellenállása miatt viszont megjelenik egy konstans (hőmérséklet-független) soros ellenállás, ami miatt a mért hőmérsékletérték korrekcióra szorul.
- Ebből milyen irányú hőmérsékleti korrekciót várunk?
Mindkét termosz hőmérőjét hitelesítsük hideg csapvízben higanyszálas hőmérő segítségével! Határozzuk meg a soros ellenállás értékét és az ebből adódó hőmérsékleti korrekciót!
- Melyik mérési feladatnál okozná a legnagyobb problémát, ha a hőmérők nullponteltolódását nem vennénk figyelembe?
2. A termosz hőveszteségének becslése
Töltsünk a termoszba forró vizet, várjuk meg amíg a rendszer termalizálódik. Ezután a rendszer a nem teljesen tökéletes szigetelés miatt kismértékben hőt ad le a környezetének, és emiatt lassan csökken a hőmérséklete. Becsüljük meg a hőleadás sebességét!
- A hőleadást legalább 5 percen keresztül mérjük!
- Adjunk számszerű becslést arra, hogy a termosz hőveszteségének elhanyagolása illetve a fent részletezett hőmérsékleti korrekció elhagyása milyen nagyságrendű hibát okozna az alábbi méréseknél!
3. A termosz hőkapacitásának becslése
Mérjük meg a rozsdamentes termosz tömegét! A rozsdamentes acél fajhője 500 J/kg°C, termosz külső és belső falának vastagsága megegyezik. Becsüljük meg a termosz saját hőkapacitását!
4. A víz fajhőjének mérése fűtéses módszerrel
Töltsünk az egyik termoszba 0,6 l hideg csapvizet. Helyezzük a fűtőellenállást az edénybe, és 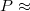 50 W fűtőteljesítmény mellett mérjük a víz melegedését 10 percen keresztül.
50 W fűtőteljesítmény mellett mérjük a víz melegedését 10 percen keresztül.
- Az 50 W fűtőteljesítményt csak a már vízbe helyezett fűtőellenállásra alkalmazzuk, levegőben ez a fűtőteljesítmény az ellenállás károsodásához vezethet!
- A pontos fűtőteljesítmény meghatározásához digitális multiméterrel mérjük meg az áram és a feszültség pontos értékét.
A leadott hőmennyiség és a mért hőmérséklet-változás alapján határozzuk meg a víz fajhőjét!
- Az edény hőkapacitását a 3. feladatban becsült értékkel vegyük figyelembe.
5. A termosz hőkapacitásának mérése keveréses módszerrel
Forraljunk fel 0,35 l vizet, majd a forró vizet töltsük az egyik termoszba. A másik termoszba töltsünk 0,35 l hideg csapvizet. Várjuk meg az egyensúlyi hőmérsékletek beálltát. Ezután a hideg vizet töltsük át a forró vizes termoszba, és keverés mellett várjuk meg az egyensúlyi hőmérséklet kialakulását. A mért hőmérséklet-változások ill. a hideg és a forró víz tömege alapján határozzuk meg a termosz saját hőkapacitását! A mért értéket hasonlítsuk össze a 3. feladatban becsült hőkapacitással!
- A mérésekhez csak egy mágneses keverő áll rendelkezésre, ezzel mindig a meleg vizes termoszt keverjük!
FIGYELEM! A második alkalomra az eddigi feladatok előzetes kiértékelését el kell végezni és meg kell mutatni a mérésvezetőnek.
FELADATOK MÁSODIK ALKALOMMAL
Ha az első mérési alkalommal elvégzett feladatok kiértékelése során probléma adódott a mért adatok helytelensége miatt, akkor elsőként ezeket a mérési feladatokat végezze el újra.
6. Fémminta fajhőjének mérése
Forraljunk fel 0,5 l vizet, majd a forró vizet töltsük az egyik termoszba. A másik termoszba töltsünk 0,5 l hideg csapvizet. A hideg vízbe helyezzük bele a fémtömböt, várjuk meg amíg mindkét edényben kialakul az egyensúlyi hőmérséklet. A fémtömböt helyezzük át a forró vízbe, és várjuk meg a közös hőmérséklet kialakulását. A hőmérséklet-változások alapján határozzuk meg az adott fém fajhőjét!
7. A jég olvadáshőjének mérése
Forraljunk fel 0,45 l vizet, majd a forró vizet töltsük az egyik termoszba. Várjuk meg az egyensúlyi hőmérséklet kialakulását. Töltsük fel a termoszt olvadásban lévő jéggel, majd várjuk meg míg elolvad a jég, és kialakul az egyensúlyi hőmérséklet. Mérjük le a termoszban lévő víz térfogatát (vagy tömegét), ebből határozzuk meg, hogy mennyi jeget tettünk a termoszba! Határozzuk meg a jég olvadáshőjét!
8. A kalcium-klorid oldáshőjének mérése
Töltsünk 100 g desztillált vizet az edénybe, majd mérjük meg a víz egyensúlyi hőmérsékletét a digitális hőmérővel. Szórjunk a vízbe 2 g kalcium-klorid sót. Óvatosan keverve az oldatot, a termodinamikai egyensúly beállta után jegyezzük fel az oldat hőmérsékletét. Határozzuk meg a kalcium-klorid oldáshőjét! Hasonlítsuk össze a mért értéket táblázatokban található adattal! Exoterm vagy endoterm az oldódás? A desztillált víz fajhőjét vegyük táblázatokból.