Termodinamika példák - Az entrópia hőmérséklet- és térfogatfüggése, az adiabata egyenlete
A Fizipedia wikiből
(Termodinamika példák - Az entrópia hőmérséklet és térfogatfüggése, az adiabata egyenlete szócikkből átirányítva)
| [rejt] Navigáció Pt·1·2·3 |
|---|
| Kísérleti fizika 3. gyakorlat |
| Gyakorlatok listája: |
| Entrópia, II. főtétel |
| Feladatok listája: |
| © 2012-2013 BME-TTK, TÁMOP4.1.2.A/1-11/0064 |
Feladat
- Tekintsünk
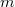 tömegű,
tömegű, 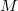 móltömegű,
móltömegű, 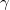 fajhőviszonyú ideális gázt.
fajhőviszonyú ideális gázt.
- a) Vezesse le az entrópia hőmérséklet- és térfogatfüggését megadó összefüggést!
- b) A kapott entrópia-kifejezés segítségével vezesse le az adiabata egyenletét!
Megoldás
a) Az entrópiaváltozás definíciója
![\[ \mathrm{d}S = \frac{\delta Q}{T}, \]](/images/math/c/b/d/cbd5cf7c09169ef24d1244b4e66f68f5.png)
amibe helyettesítsük be a közölt hő első főtételből kifejezett
![\[ \delta Q = \mathrm{d}U+p\,\mathrm{d}V \]](/images/math/f/2/1/f2158c0604f29f1f878df0d5c9709b7f.png)
alakját, ahol 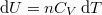 és
és 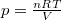 :
:
![\[ \mathrm{d}S= n C_V \frac{\mathrm{d}T}{T} + nR \frac{\mathrm{d}V}{V}. \]](/images/math/6/5/1/651158de62329408881901bb946a3ae9.png)
Kiintegrálva az egyenletet a kezdeti- és a végállapot között:
![\[ S - S_0 = n C_V \ln\frac{T}{T_0} + nR \ln\frac{V}{V_0}, \]](/images/math/c/f/0/cf0b4d0ac5c3d861eb7a0b5db0117455.png)
ahol a fajhőösszefüggések szerint 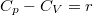 és
és 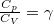 , amikből
, amikből 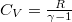 :
:
![\[ S(T,V) = nR \ln\left[ \left(\frac{T}{T_0}\right)^{\textstyle \frac{1}{\gamma-1}} \frac{V}{V_0} \right] + S_0. \]](/images/math/7/7/b/77b9f9c2a738ce8d57948e72d2c02595.png)
Ha a hőmérsékletet és a térfogatot dimenziótlanul, 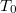 illetve
illetve 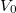 egységekben adjuk meg, akkor helyes a
egységekben adjuk meg, akkor helyes a
![\[ S(T,V) = nR \ln\left[ T^{\textstyle \frac{1}{\gamma-1}} V \right] + S_0 \]](/images/math/c/0/e/c0e3d2d948c5b6ccf0803ff72765b0fb.png)
felírás is.
b) Adiabatikus állapotváltozásban az entrópia állandó (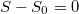 ), azaz
), azaz 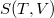 kifejezésében a logaritmus alatt
kifejezésében a logaritmus alatt 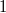 áll:
áll:
![\[ \left(\frac{T}{T_0}\right)^{\textstyle \frac{1}{\gamma-1}} \frac{V}{V_0} = 1, \]](/images/math/2/6/a/26a765a3ea82a57add8cdc2059fd8eb9.png)
vagyis az adiabata egyenlete
![\[ T^{\textstyle \frac{1}{\gamma-1}} V = \mathrm{const.} \]](/images/math/1/4/3/1437d76a36fbb4caf8342ff13193a7aa.png)