Termodinamika példák - Entrópiaváltozás forraláskor
A Fizipedia wikiből
| [rejt] Navigáció Pt·1·2·3 |
|---|
| Kísérleti fizika 3. gyakorlat |
| Gyakorlatok listája: |
| Entrópia, II. főtétel |
| Feladatok listája: |
| © 2012-2013 BME-TTK, TÁMOP4.1.2.A/1-11/0064 |
Feladat
-
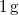
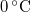 -os víz állandó nyomáson
-os víz állandó nyomáson 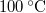 -os gőzzé alakul. Határozzuk meg a folyamat alatt bekövetkező entrópiaváltozást!.
-os gőzzé alakul. Határozzuk meg a folyamat alatt bekövetkező entrópiaváltozást!.
Megoldás
Az entrópiát kifejezhetjük az ún. redukált hővel: 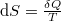 , ahol a hőközlést két részre bontjuk.
, ahol a hőközlést két részre bontjuk.
A melegítés során a kezdetben 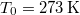 -es
-es 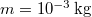 tömegű víz hőmérséklete folytonosan nő
tömegű víz hőmérséklete folytonosan nő 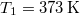 -re:
-re:
![\[ \Delta S_\text{melegítés} = \int_{T_0}^{T_1}\frac{\delta Q}{T} = cm \int_{T_0}^{T_1} \frac{\mathrm{d}T}{T} = cm \ln \frac{T_1}{T_0}, \]](/images/math/e/e/6/ee6c28f152c4b6ed422652617939a94a.png)
ahol 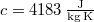 a víz fajhője.
a víz fajhője.
A forralás pedig állandó hőmérsékleten megy végbe, 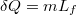 :
:
![\[ \Delta S_\text{forralás} = \frac{m L_f}{T_1}, \]](/images/math/c/f/0/cf0e22dcc56ec86e1572af14eedd5170.png)
ahol 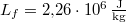 a víz forráshője.
a víz forráshője.
A víz teljes entrópiaváltozása az előző két rész összege:
![\[ \Delta S = mc\ln\frac{T_1}{T_0}+\frac{mL_f}{T_1}, \]](/images/math/c/e/d/ced7a2c337cc1db1723e9a3cb85db7c8.png)
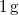 vízre
vízre 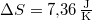 .
.