„Termodinamika példák - Entrópiaváltozás izobár táguláskor” változatai közötti eltérés
A Fizipedia wikiből
(Új oldal, tartalma: „<noinclude> Kategória:Kísérleti fizika 3. gyakorlat Kategória:Szerkesztő:Stippinger Kategória:Termodinamika - Entrópia, II. főtétel {{Kísérleti fizi…”) |
a (Szöveg koherenssé tétele) |
||
| (egy szerkesztő 2 közbeeső változata nincs mutatva) | |||
| 9. sor: | 9. sor: | ||
}} | }} | ||
== Feladat == | == Feladat == | ||
| − | </noinclude><wlatex># Mennyivel változik meg $m=1\,\mathrm{g}$ nitrogéngáz entrópiája, ha állandó nyomáson $V_1=1\,\mathrm{l}$ térfogatról $V_2=5\,\mathrm{l}$ térfogatra expandáltatjuk.</wlatex><includeonly><wlatex>{{Végeredmény|content=$$\Delta S=\frac{m}{ | + | </noinclude><wlatex># Mennyivel változik meg $m=1\,\mathrm{g}$ nitrogéngáz entrópiája, ha állandó nyomáson $V_1=1\,\mathrm{l}$ térfogatról $V_2=5\,\mathrm{l}$ térfogatra expandáltatjuk.</wlatex><includeonly><wlatex>{{Végeredmény|content=$$\Delta S=\frac{m}{\mu_\mathrm{N_2}}C_p\ln\frac{V_2}{V_1}=3{,}34\,\mathrm{\frac{J}{K}}, \qquad C_p=\frac72R.$$}}</wlatex></includeonly><noinclude> |
| + | |||
== Megoldás == | == Megoldás == | ||
| − | <wlatex> | + | <wlatex>Az entrópiaváltozás definíciója |
| + | $$ \mathrm{d}S = \frac{\delta Q}{T}, $$ | ||
| + | amibe helyettesítsük be a közölt hő első főtételből kifejezett | ||
| + | $$ \delta Q = \mathrm{d}U+p\,\mathrm{d}V $$ | ||
| + | alakját, ahol $ \mathrm{d}U=n C_V\,\mathrm{d}T $ és $ p=\frac{nRT}{V}$: | ||
| + | $$ \mathrm{d}S= n C_V \frac{\mathrm{d}T}{T} + nR \frac{\mathrm{d}V}{V}. $$ | ||
| + | |||
| + | Kiintegrálva az egyenletet $1$ kezdeti- és $2$ végállapot között: | ||
| + | $$ S_2 - S_1 = n C_V \ln\frac{T_2}{T_1} + nR \ln\frac{V_2}{V_1}, $$ | ||
| + | ahol most izotermikusan $p_2=p_1=p$ ezért $T_i=\frac{p}{nR}{V_i}$ ($i=1,2$): | ||
| + | $$ \Delta S = n C_p \ln \frac{V_2}{V_1}, $$ | ||
| + | ahol $n=\frac{m}{\mu_\mathrm{N_2}}$. | ||
| + | A nitrogén kétatomos közel ideális gáz ($C_p=\frac{f+2}{2}R=\frac{7}{2}$), móltömege $\mu_\mathrm{N_2}=14{,}01\,\mathrm{\frac{g}{mol}}$, amikkel $\Delta S = 3{,}34\,\mathrm{\frac{J}{K}}$. | ||
</wlatex> | </wlatex> | ||
</noinclude> | </noinclude> | ||
A lap jelenlegi, 2013. május 5., 00:13-kori változata
| [rejt] Navigáció Pt·1·2·3 |
|---|
| Kísérleti fizika 3. gyakorlat |
| Gyakorlatok listája: |
| Entrópia, II. főtétel |
| Feladatok listája: |
| © 2012-2013 BME-TTK, TÁMOP4.1.2.A/1-11/0064 |
Feladat
- Mennyivel változik meg
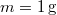 nitrogéngáz entrópiája, ha állandó nyomáson
nitrogéngáz entrópiája, ha állandó nyomáson 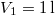 térfogatról
térfogatról 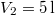 térfogatra expandáltatjuk.
térfogatra expandáltatjuk.
Megoldás
Az entrópiaváltozás definíciója
![\[ \mathrm{d}S = \frac{\delta Q}{T}, \]](/images/math/c/b/d/cbd5cf7c09169ef24d1244b4e66f68f5.png)
amibe helyettesítsük be a közölt hő első főtételből kifejezett
![\[ \delta Q = \mathrm{d}U+p\,\mathrm{d}V \]](/images/math/f/2/1/f2158c0604f29f1f878df0d5c9709b7f.png)
alakját, ahol 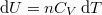 és
és 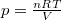 :
:
![\[ \mathrm{d}S= n C_V \frac{\mathrm{d}T}{T} + nR \frac{\mathrm{d}V}{V}. \]](/images/math/6/5/1/651158de62329408881901bb946a3ae9.png)
Kiintegrálva az egyenletet 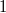 kezdeti- és
kezdeti- és 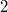 végállapot között:
végállapot között:
![\[ S_2 - S_1 = n C_V \ln\frac{T_2}{T_1} + nR \ln\frac{V_2}{V_1}, \]](/images/math/d/f/1/df173414052f078a4bc508e9e42cdf8f.png)
ahol most izotermikusan 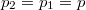 ezért
ezért 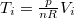 (
(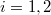 ):
):
![\[ \Delta S = n C_p \ln \frac{V_2}{V_1}, \]](/images/math/0/f/8/0f8c5c16c17844cf1b9d1a87bd9541fb.png)
ahol 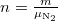 .
A nitrogén kétatomos közel ideális gáz (
.
A nitrogén kétatomos közel ideális gáz (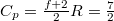 ), móltömege
), móltömege 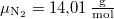 , amikkel
, amikkel 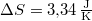 .
.