„Termodinamika példák - Entrópiaváltozás izoterm táguláskor” változatai közötti eltérés
A Fizipedia wikiből
a (Szöveg koherenssé tétele) |
|||
| (egy szerkesztő 3 közbeeső változata nincs mutatva) | |||
| 10. sor: | 10. sor: | ||
== Feladat == | == Feladat == | ||
</noinclude><wlatex># $p_1=2\cdot {10}^6\,\mathrm{Pa}$ nyomású, $T=27\,\mathrm{^\circ C}$ hőmérsékletű és $ V_1=1\,\mathrm{l}$ térfogatú ideális gáz izotermikusan $p_2={10}^5\,\mathrm{Pa}$ nyomásig terjed ki. Mennyivel változott meg eközben az entrópiája? | </noinclude><wlatex># $p_1=2\cdot {10}^6\,\mathrm{Pa}$ nyomású, $T=27\,\mathrm{^\circ C}$ hőmérsékletű és $ V_1=1\,\mathrm{l}$ térfogatú ideális gáz izotermikusan $p_2={10}^5\,\mathrm{Pa}$ nyomásig terjed ki. Mennyivel változott meg eközben az entrópiája? | ||
| − | </wlatex><includeonly><wlatex>{{Útmutatás|content=Használjuk az entrópiaváltozás definícióját és az állapotegyenletet!}}</wlatex><wlatex>{{Végeredmény|content=$$\Delta S=\frac{p_1 V_1}{T}\ln\frac{p_1}{p_2}$$}}</wlatex></includeonly><noinclude> | + | </wlatex><includeonly><wlatex>{{Útmutatás|content=Használjuk az entrópiaváltozás definícióját és az állapotegyenletet!}}</wlatex><wlatex>{{Végeredmény|content=$$\Delta S=\frac{p_1 V_1}{T}\ln\frac{p_1}{p_2}=19{,}97\,\mathrm{\frac{J}{K}}$$}}</wlatex></includeonly><noinclude> |
== Megoldás == | == Megoldás == | ||
<wlatex>Az entrópiaváltozás definíciója | <wlatex>Az entrópiaváltozás definíciója | ||
| − | $$ mathrm{d}S = \frac{\delta Q}{T}, $$ | + | $$ \mathrm{d}S = \frac{\delta Q}{T}, $$ |
amibe helyettesítsük be a közölt hő első főtételből kifejezett | amibe helyettesítsük be a közölt hő első főtételből kifejezett | ||
| − | $$ \delta Q = mathrm{d}U+p\,mathrm{d}V $$ | + | $$ \delta Q = \mathrm{d}U+p\,\mathrm{d}V $$ |
| − | alakját, ahol $ mathrm{d}U=n C_V\,mathrm{d}T $ és $ p=\frac{nRT}{V}$: | + | alakját, ahol $ \mathrm{d}U=n C_V\,\mathrm{d}T $ és $ p=\frac{nRT}{V}$: |
| − | $$ mathrm{d}S= n C_V \frac{mathrm{d}T}{T} + nR \frac{mathrm{d}V}{V}. $$ | + | $$ \mathrm{d}S = n C_V \frac{\mathrm{d}T}{T} + nR \frac{\mathrm{d}V}{V}. $$ |
Kiintegrálva az egyenletet $1$ kezdeti- és $2$ végállapot között: | Kiintegrálva az egyenletet $1$ kezdeti- és $2$ végállapot között: | ||
| − | $$ S_2 - S_1 = | + | $$ S_2 - S_1 = n C_V \ln\frac{T_2}{T_1} + nR \ln\frac{V_2}{V_1}, $$ |
| − | ahol most izotermikusan $T_2=T_1=T$ ($\mathrm{d}T=0$)és $p_i=\ | + | ahol most izotermikusan $T_2=T_1=T$ ($\mathrm{d}T=0$) és $p_i=\frac{nRT}{V_i}$ ($i=1,2$): |
| − | $ \Delta S =\frac{p_1 V_1}{T} \ln \frac{p_1}{p_2} | + | $$ \Delta S =\frac{p_1 V_1}{T} \ln \frac{p_1}{p_2}, $$ |
| + | a megadott állapotváltozásra $\Delta S=19{,}97\,\mathrm{\frac{J}{K}}$. | ||
</wlatex> | </wlatex> | ||
</noinclude> | </noinclude> | ||
A lap jelenlegi, 2013. május 4., 23:56-kori változata
| [rejt] Navigáció Pt·1·2·3 |
|---|
| Kísérleti fizika 3. gyakorlat |
| Gyakorlatok listája: |
| Entrópia, II. főtétel |
| Feladatok listája: |
| © 2012-2013 BME-TTK, TÁMOP4.1.2.A/1-11/0064 |
Feladat
-
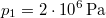 nyomású,
nyomású, 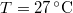 hőmérsékletű és
hőmérsékletű és 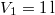 térfogatú ideális gáz izotermikusan
térfogatú ideális gáz izotermikusan 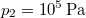 nyomásig terjed ki. Mennyivel változott meg eközben az entrópiája?
nyomásig terjed ki. Mennyivel változott meg eközben az entrópiája?
Megoldás
Az entrópiaváltozás definíciója
![\[ \mathrm{d}S = \frac{\delta Q}{T}, \]](/images/math/c/b/d/cbd5cf7c09169ef24d1244b4e66f68f5.png)
amibe helyettesítsük be a közölt hő első főtételből kifejezett
![\[ \delta Q = \mathrm{d}U+p\,\mathrm{d}V \]](/images/math/f/2/1/f2158c0604f29f1f878df0d5c9709b7f.png)
alakját, ahol 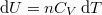 és
és 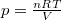 :
:
![\[ \mathrm{d}S = n C_V \frac{\mathrm{d}T}{T} + nR \frac{\mathrm{d}V}{V}. \]](/images/math/a/0/b/a0b12548a4cb6f5c634273feb546317b.png)
Kiintegrálva az egyenletet 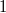 kezdeti- és
kezdeti- és 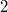 végállapot között:
végállapot között:
![\[ S_2 - S_1 = n C_V \ln\frac{T_2}{T_1} + nR \ln\frac{V_2}{V_1}, \]](/images/math/d/f/1/df173414052f078a4bc508e9e42cdf8f.png)
ahol most izotermikusan 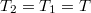 (
(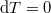 ) és
) és 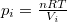 (
(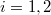 ):
):
![\[ \Delta S =\frac{p_1 V_1}{T} \ln \frac{p_1}{p_2}, \]](/images/math/6/4/8/6481c9b30c460e2a0a7fba30716970e4.png)
a megadott állapotváltozásra 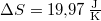 .
.