„Termodinamika példák - Entrópiaváltozás egyensúlyig kaloriméterben” változatai közötti eltérés
A Fizipedia wikiből
a (Szöveg koherenssé tétele.) |
|||
| (egy szerkesztő egy közbeeső változata nincs mutatva) | |||
| 9. sor: | 9. sor: | ||
}} | }} | ||
== Feladat == | == Feladat == | ||
| − | </noinclude><wlatex># $0, | + | </noinclude><wlatex># $0{,}2\,\mathrm{kg}$, $100\,\mathrm{^\circ C}$ hőmérsékletű vasat hőszigetelt kaloriméterben lévő, $0{,}5\,\mathrm{kg}$, $12\,\mathrm{^\circ C}$-os vízbe teszünk. A vas fajhője $c_1=0{,}46\cdot {10}^3\,\mathrm{\frac{J}{kg\,K}}$, a vízé $c_2=4{,}18\cdot {10}^3\,\mathrm{\frac{J}{kg\,K}}$. Mennyi az entrópiaváltozás a hőmérséklet kiegyenlítődése miatt, ha a nyomás állandó?</wlatex><includeonly><wlatex>{{Végeredmény|content=$$T_k=288{,}7\,\mathrm{K},\qquad \Delta S=3{,}41\,\mathrm{\frac{J}{K}}$$}}</wlatex></includeonly><noinclude> |
| + | |||
== Megoldás == | == Megoldás == | ||
| − | <wlatex>A közös $T_k$ hőmérsékletet | + | <wlatex>A közös $T_k$ hőmérsékletet abból kapjuk meg, hogy a vas által leadott hő megegyezik a víz által felvett hővel: |
| − | $$ c_1 m_1\left(T_1-T_k\right)= c_2 m_2\left(T_k-T_2\right), $$ | + | $$ c_1 m_1\left(T_1-T_k\right) = c_2 m_2\left(T_k-T_2\right), $$ |
| − | ahol $T_1=373\,\mathrm{K}>T_k>T_2=285\,\mathrm{K}$ a vas kezdeti, a közös és víz kezdeti hőmérséklete, $m_1=0, | + | ahol $T_1=373\,\mathrm{K}>T_k>T_2=285\,\mathrm{K}$ rendre a vas kezdeti, a közös és víz kezdeti hőmérséklete, $m_1=0{,}2\,\mathrm{kg}$ a vas, $m_2=0{,}5\,\mathrm{kg}$ a víz tömege. |
| − | $$ T_k = \frac{c_1 m_1 T_1+ c_2 m_2 T_2}{c_1 m_1+ c_2 m_2}\approx 288, | + | $$ T_k = \frac{c_1 m_1 T_1+ c_2 m_2 T_2}{c_1 m_1+ c_2 m_2}\approx 288{,}7\,\mathrm{K}. $$ |
Az entrópiaváltozás a részrendszerek entrópiaváltozásának összege: | Az entrópiaváltozás a részrendszerek entrópiaváltozásának összege: | ||
$$ \Delta S = \int_{T_1}^{T_k} \frac{c_1 m_1} T\,\mathrm{d}T + \int_{T_2}^{T_k} \frac{c_2 m_2} T\,\mathrm{d}T | $$ \Delta S = \int_{T_1}^{T_k} \frac{c_1 m_1} T\,\mathrm{d}T + \int_{T_2}^{T_k} \frac{c_2 m_2} T\,\mathrm{d}T | ||
= c_1 m_1 \ln\frac{T_k}{T_1} + c_2 m_2 \ln\frac{T_k}{T_2} | = c_1 m_1 \ln\frac{T_k}{T_1} + c_2 m_2 \ln\frac{T_k}{T_2} | ||
| − | \approx - 23, | + | \approx - 23{,}57 \mathrm{\frac{J}{K}} + 26{,}97 \mathrm{\frac{J}{K}} |
| − | = 3, | + | = 3{,}41 \mathrm{\frac{J}{K}}. $$ |
</wlatex> | </wlatex> | ||
</noinclude> | </noinclude> | ||
A lap jelenlegi, 2013. május 20., 11:41-kori változata
| Navigáció Pt·1·2·3 |
|---|
| Kísérleti fizika 3. gyakorlat |
| Gyakorlatok listája: |
| Entrópia, II. főtétel |
| Feladatok listája: |
| © 2012-2013 BME-TTK, TÁMOP4.1.2.A/1-11/0064 |
Feladat
-
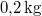 ,
, 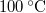 hőmérsékletű vasat hőszigetelt kaloriméterben lévő,
hőmérsékletű vasat hőszigetelt kaloriméterben lévő, 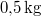 ,
, 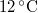 -os vízbe teszünk. A vas fajhője
-os vízbe teszünk. A vas fajhője 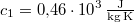 , a vízé
, a vízé 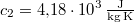 . Mennyi az entrópiaváltozás a hőmérséklet kiegyenlítődése miatt, ha a nyomás állandó?
. Mennyi az entrópiaváltozás a hőmérséklet kiegyenlítődése miatt, ha a nyomás állandó?
Megoldás
A közös 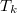 hőmérsékletet abból kapjuk meg, hogy a vas által leadott hő megegyezik a víz által felvett hővel:
hőmérsékletet abból kapjuk meg, hogy a vas által leadott hő megegyezik a víz által felvett hővel:
![\[ c_1 m_1\left(T_1-T_k\right) = c_2 m_2\left(T_k-T_2\right), \]](/images/math/0/2/9/02951c3781a3ec73663516e9f5623706.png)
ahol 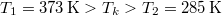 rendre a vas kezdeti, a közös és víz kezdeti hőmérséklete,
rendre a vas kezdeti, a közös és víz kezdeti hőmérséklete, 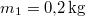 a vas,
a vas, 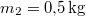 a víz tömege.
a víz tömege.
![\[ T_k = \frac{c_1 m_1 T_1+ c_2 m_2 T_2}{c_1 m_1+ c_2 m_2}\approx 288{,}7\,\mathrm{K}. \]](/images/math/9/9/c/99c652dc13378053792469df258c0a7f.png)
Az entrópiaváltozás a részrendszerek entrópiaváltozásának összege:
![\[ \Delta S = \int_{T_1}^{T_k} \frac{c_1 m_1} T\,\mathrm{d}T + \int_{T_2}^{T_k} \frac{c_2 m_2} T\,\mathrm{d}T = c_1 m_1 \ln\frac{T_k}{T_1} + c_2 m_2 \ln\frac{T_k}{T_2} \approx - 23{,}57 \mathrm{\frac{J}{K}} + 26{,}97 \mathrm{\frac{J}{K}} = 3{,}41 \mathrm{\frac{J}{K}}. \]](/images/math/7/a/2/7a20e7c08d2085589cd1932cca84299b.png)