„Termodinamika példák - Entrópiaváltozás forraláskor” változatai közötti eltérés
A Fizipedia wikiből
(→Megoldás) |
|||
| 12. sor: | 12. sor: | ||
</wlatex><includeonly><wlatex>{{Végeredmény|content=$$\Delta S = mc\ln\frac{373}{273}+\frac{mq}{373},$$ $m=10^{-3}\,\mathrm{kg}$ a víz tömege, $c$ a víz fajhője, $L_f$ a forráshője.}}</wlatex></includeonly><noinclude> | </wlatex><includeonly><wlatex>{{Végeredmény|content=$$\Delta S = mc\ln\frac{373}{273}+\frac{mq}{373},$$ $m=10^{-3}\,\mathrm{kg}$ a víz tömege, $c$ a víz fajhője, $L_f$ a forráshője.}}</wlatex></includeonly><noinclude> | ||
== Megoldás == | == Megoldás == | ||
| − | <wlatex>Az entrópiát kifejezhetjük az ún. redukált hővel: $\mathrm{d}S=\ | + | <wlatex>Az entrópiát kifejezhetjük az ún. redukált hővel: $\mathrm{d}S=\frac{\delta Q}{T}$, ahol a hőközlést két részre bontjuk. |
A melegítés során a kezdetben $T_0 = 273\,\mathrm{K}$-es $m=10^{-3}\,\mathrm{kg}$ tömegű víz hőmérséklete folytonosan nő $T_1 = 373\,\mathrm{K}$-re: | A melegítés során a kezdetben $T_0 = 273\,\mathrm{K}$-es $m=10^{-3}\,\mathrm{kg}$ tömegű víz hőmérséklete folytonosan nő $T_1 = 373\,\mathrm{K}$-re: | ||
$$ \Delta S_\text{melegítés} = \int_{T_0}^{T_1}\frac{\delta Q}{T} = cm \int_{T_0}^{T_1} \frac{\mathrm{d}T}{T} = cm \ln \frac{T_1}{T_0}, $$ | $$ \Delta S_\text{melegítés} = \int_{T_0}^{T_1}\frac{\delta Q}{T} = cm \int_{T_0}^{T_1} \frac{\mathrm{d}T}{T} = cm \ln \frac{T_1}{T_0}, $$ | ||
| − | ahol $c=4173\,\mathrm{\frac{J}{kg\,K}$ a víz fajhője. | + | ahol $c=4173\,\mathrm{\frac{J}{kg\,K}}$ a víz fajhője. |
A forralás pedig állandó hőmérsékleten megy végbe, $\delta Q=m L_f$: | A forralás pedig állandó hőmérsékleten megy végbe, $\delta Q=m L_f$: | ||
A lap 2013. április 14., 00:04-kori változata
| [rejt] Navigáció Pt·1·2·3 |
|---|
| Kísérleti fizika 3. gyakorlat |
| Gyakorlatok listája: |
| Entrópia, II. főtétel |
| Feladatok listája: |
| © 2012-2013 BME-TTK, TÁMOP4.1.2.A/1-11/0064 |
Feladat
-
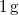
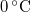 -os víz állandó nyomáson
-os víz állandó nyomáson 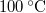 -os gőzzé alakul. Határozzuk meg a folyamat alatt bekövetkező entrópiaváltozást!.
-os gőzzé alakul. Határozzuk meg a folyamat alatt bekövetkező entrópiaváltozást!.
Megoldás
Az entrópiát kifejezhetjük az ún. redukált hővel: 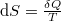 , ahol a hőközlést két részre bontjuk.
, ahol a hőközlést két részre bontjuk.
A melegítés során a kezdetben 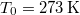 -es
-es 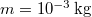 tömegű víz hőmérséklete folytonosan nő
tömegű víz hőmérséklete folytonosan nő 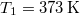 -re:
-re:
![\[ \Delta S_\text{melegítés} = \int_{T_0}^{T_1}\frac{\delta Q}{T} = cm \int_{T_0}^{T_1} \frac{\mathrm{d}T}{T} = cm \ln \frac{T_1}{T_0}, \]](/images/math/e/e/6/ee6c28f152c4b6ed422652617939a94a.png)
ahol 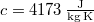 a víz fajhője.
a víz fajhője.
A forralás pedig állandó hőmérsékleten megy végbe, 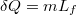 :
:
![\[ \Delta S_\text{forralás} = \frac{m L_f}{T_1}, \]](/images/math/c/f/0/cf0e22dcc56ec86e1572af14eedd5170.png)
ahol 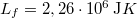 a víz forráshője.
a víz forráshője.
A víz teljes entrópiaváltozása az előző két rész összege:
![\[\Delta S = mc\ln\frac{373}{273}+\frac{mL_f}{373}.\]](/images/math/6/3/9/63989c4d7291357464cc8ee17212a7de.png)