Termodinamika példák - Entrópiaváltozás izoterm táguláskor
A Fizipedia wikiből
A lap korábbi változatát látod, amilyen Stippinger (vitalap | szerkesztései) 2013. május 4., 23:56-kor történt szerkesztése után volt.
| [rejt] Navigáció Pt·1·2·3 |
|---|
| Kísérleti fizika 3. gyakorlat |
| Gyakorlatok listája: |
| Entrópia, II. főtétel |
| Feladatok listája: |
| © 2012-2013 BME-TTK, TÁMOP4.1.2.A/1-11/0064 |
Feladat
-
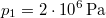 nyomású,
nyomású, 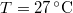 hőmérsékletű és
hőmérsékletű és 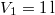 térfogatú ideális gáz izotermikusan
térfogatú ideális gáz izotermikusan 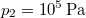 nyomásig terjed ki. Mennyivel változott meg eközben az entrópiája?
nyomásig terjed ki. Mennyivel változott meg eközben az entrópiája?
Megoldás
Az entrópiaváltozás definíciója
![\[ \mathrm{d}S = \frac{\delta Q}{T}, \]](/images/math/c/b/d/cbd5cf7c09169ef24d1244b4e66f68f5.png)
amibe helyettesítsük be a közölt hő első főtételből kifejezett
![\[ \delta Q = \mathrm{d}U+p\,\mathrm{d}V \]](/images/math/f/2/1/f2158c0604f29f1f878df0d5c9709b7f.png)
alakját, ahol 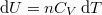 és
és 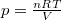 :
:
![\[ \mathrm{d}S = n C_V \frac{\mathrm{d}T}{T} + nR \frac{\mathrm{d}V}{V}. \]](/images/math/a/0/b/a0b12548a4cb6f5c634273feb546317b.png)
Kiintegrálva az egyenletet  kezdeti- és
kezdeti- és  végállapot között:
végállapot között:
![\[ S_2 - S_1 = n C_V \ln\frac{T_2}{T_1} + nR \ln\frac{V_2}{V_1}, \]](/images/math/d/f/1/df173414052f078a4bc508e9e42cdf8f.png)
ahol most izotermikusan 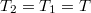 (
(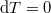 ) és
) és 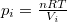 (
(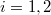 ):
):
![\[ \Delta S =\frac{p_1 V_1}{T} \ln \frac{p_1}{p_2}, \]](/images/math/6/4/8/6481c9b30c460e2a0a7fba30716970e4.png)
a megadott állapotváltozásra 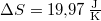 .
.