Termodinamika példák - Entrópiaváltozás hőcserében
| [rejt] Navigáció Pt·1·2·3 |
|---|
| Kísérleti fizika 3. gyakorlat |
| Gyakorlatok listája: |
| Entrópia, II. főtétel |
| Feladatok listája: |
| © 2012-2013 BME-TTK, TÁMOP4.1.2.A/1-11/0064 |
Feladat
-
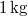 tömegű,
tömegű, 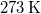 hőmérsékletű vizet termikus kapcsolatba hozunk egy
hőmérsékletű vizet termikus kapcsolatba hozunk egy 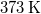 hőmérsékletű hőtartállyal.
hőmérsékletű hőtartállyal.
- a) Mekkora a víz entrópia-változása, miután a hőmérséklete elérte a hőtartály hőmérsékletét?
- b) Mekkora eközben a hőtartály entrópia-változása?
- c) Mekkora a teljes rendszerben (hőtartály és víz) létrejött entrópia-változás?
- d) Mennyi a teljes rendszerben létrejött entrópia-változás, ha a testet először egy 323 K hőmérsékletű hőtartállyal, majd az egyensúly beállta után a 373 K hőmérsékletű hőtartállyal hozzuk kapcsolatba?
- e) Lehet-e úgy melegíteni a vizet, hogy a teljes rendszer entrópia-változása kisebb legyen egy előírt értéknél (vagyis a folyamat előírt mértékben megközelítse a reverzíbilis folyamatot)?
Megoldás
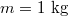 ,
, 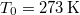 ,
, 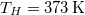
a) A víz a közölt 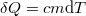 hőt az aktuális
hőt az aktuális  hőmérsékletén veszi fel:
hőmérsékletén veszi fel:
![\[ \Delta S_\text{víz}=\int_{T_0}^{T_H} \frac{\delta Q}{T}=cm\ln \frac{T_H}{T_0}. \]](/images/math/5/e/a/5ea738117f235795cd30a798aa367bde.png)
b) A hőtartály hőmérséklete állandóan 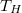 , az általa leadott összes hőmennyiség nagysága megegyezik a víz által felvettel:
, az általa leadott összes hőmennyiség nagysága megegyezik a víz által felvettel:
![\[ \Delta S_\text{hőtartály} = \frac{\Delta Q}{T_H} = \frac{-cm(T_H-T_0)}{T_H} = cm\left(\frac{T_0}{T_H}-1\right). \]](/images/math/0/e/3/0e3623f08df3c665a220d8e9a3cd52d5.png)
c) A teljes rendszer (vagy az univerzum) entrópiaváltozása a folyamat következtében
![\[ \Delta S = \Delta S_\text{víz} + \Delta S_\text{hőtartály} = cm\left(\left(\frac{T_0}{T_H}-1\right)-\ln \frac{T_0}{T_H}\right) \ge 0\]](/images/math/a/e/5/ae5eaa917b21a7615fc823d763e8cfbf.png)
d) Ha beiktatunk egy közbülső, 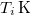 hőmérsékletű hőtartályt, a víz entrópiaváltozása ugyanaz marad:
hőmérsékletű hőtartályt, a víz entrópiaváltozása ugyanaz marad:
![\[ \Delta S_\text{víz}=\int_{T_0}^{T_i} \frac{\delta Q}{T}+\int_{T_i}^{T_H} \frac{\delta Q}{T}=\int_{T_0}^{T_H} \frac{\delta Q}{T}=cm\ln \frac{T_H}{T_0}, \]](/images/math/0/9/7/097b85ab959cd1f0de667be2ba2fac85.png)
a hőtartályok viszont összességében is kisebb entrópianövekedést szenvednek el:
![\[ \Delta S_\text{hőtartályok} = \frac{\Delta Q}{T_H} = \frac{-cm(T_i-T_0)}{T_i} + \frac{-cm(T_H-T_i)}{T_H} = cm\left(\frac{T_0}{T_i}+\frac{T_i}{T_H}-2\right). \]](/images/math/a/a/2/aa2316d90e2d1365e83167c6ec97f0c6.png)
A teljes rendszer entrópia
![\[ \Delta S = cm \left(\frac{T_0}{T_i}+\frac{T_i}{T_H}-2 - \ln \frac{T_0}{T_H}\right), \]](/images/math/f/2/0/f20980d427a783882e6614d8f012fffe.png)
ami kisebb, mint c)-ben.
Megjegyzés
Behelyettesítés nélkül a
![\[ \Delta S = cm \left(\frac{T_0}{T_H}-1-\left[1+\frac{T_0}{T_H}-\frac{T_0}{T_i}-\frac{T_i}{T_H}\right]\right)\]](/images/math/7/4/b/74b1f3a06ec2060d4873a1007e762fab.png)
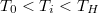 értékre látható, hogy a c)-ben kapottnál kiseb érték adódott.
értékre látható, hogy a c)-ben kapottnál kiseb érték adódott.
A 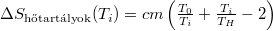 függvény szélsőértékvizsgálatával belátható, hogy a legkisebb entrópiaváltozáshoz vezető hőmérséklet
függvény szélsőértékvizsgálatával belátható, hogy a legkisebb entrópiaváltozáshoz vezető hőmérséklet 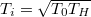 , a hozzá tartozó entrópiaváltozás
, a hozzá tartozó entrópiaváltozás 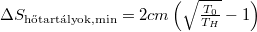
e) Láttuk, hogy egy köztes hőtartály csökkenti az entrópia-növekedést. Használjunk 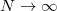 darab hőtartályt ekvidisztáns
darab hőtartályt ekvidisztáns 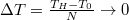 hőmérsékletkülönbségekkel!
hőmérsékletkülönbségekkel!
A víz entrópiaváltozása most is
![\[ \Delta S_\text{víz}=\int_{T_0}^{T_H} \frac{\delta Q}{T}=cm\ln \frac{T_H}{T_0} \]](/images/math/4/b/1/4b174e78d1a6c9ec77a271d7a1aabdae.png)
lesz, mivel a köztes hőmérsékletek kiesnek a képletből
A hőtartályokra:
![\[ \Delta S_\text{hőtartályok} = \lim_{\substack{N\to\infty \\ \Delta T\to0}} cm \left(\frac{\Delta T}{T_1}+\frac{\Delta T}{T_2}+\ldots+\frac{\Delta T}{T_N}\right)=\]](/images/math/6/1/2/61294431d74f8c3301bf2a6bb272d8c0.png)
![\[ = -cm \lim_{\substack{N\to\infty \\ \Delta T\to0}} \sum _{i=1}^N\frac{\Delta T}{T_i} = cm\int_{T_0}^{T_H}\frac{\mathrm{d}T}{T}=-cm\ln \frac{T_H}{T_0} \]](/images/math/a/9/9/a99a5792c01ef359635cdbe2ca2577ee.png)
Tehát így 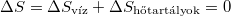 tetszőlegesen megközelíthető.
tetszőlegesen megközelíthető.