„Termodinamika példák - Keveredési entrópia, Gibbs-paradoxon” változatai közötti eltérés
A Fizipedia wikiből
(Új oldal, tartalma: „<noinclude> Kategória:Kísérleti fizika 3. gyakorlat Kategória:Szerkesztő:Stippinger Kategória:Termodinamika - Entrópia, II. főtétel {{Kísérleti fizi…”) |
(→Feladat) |
||
| 12. sor: | 12. sor: | ||
#* a) <wlatex>Indokoljuk meg, hogy a folyamatban miért nem változik a hőmérséklet és a nyomás!</wlatex><includeonly><wlatex>{{Végeredmény|content=Ideális gázról van szó és érvényes a Dalton-törvény.}}</wlatex></includeonly> | #* a) <wlatex>Indokoljuk meg, hogy a folyamatban miért nem változik a hőmérséklet és a nyomás!</wlatex><includeonly><wlatex>{{Végeredmény|content=Ideális gázról van szó és érvényes a Dalton-törvény.}}</wlatex></includeonly> | ||
#* b) <wlatex>Határozzuk meg az entrópia-változást (az ún. keverési entrópiát), és fejezzük ki a gázok $n_1$ és $n_2$ mólszámaival! | #* b) <wlatex>Határozzuk meg az entrópia-változást (az ún. keverési entrópiát), és fejezzük ki a gázok $n_1$ és $n_2$ mólszámaival! | ||
| − | <includeonly><wlatex>{{Útmutatás|content=Alkalmazzuk az [[Termodinamika példák - Ideális gáz entrópiája|Ideális gáz entrópiájáról szóló feladatban]] kapott entrópia-kifejezést, tegyük fel, hogy a teljes edényt kitöltő két gáz mindegyikének entrópiája úgy számítható, mintha a másik nem lenne jelen, és használjuk fel a Dalton-törvényt.}}{{Végeredmény|content=$$\Delta S = R n_1 \ln\frac{n_1+n_1}{n_1} + R n_2 \ln\frac{n_1+n_2}{n_2}$$}}</wlatex></includeonly> | + | </wlatex><includeonly><wlatex>{{Útmutatás|content=Alkalmazzuk az [[Termodinamika példák - Ideális gáz entrópiája|Ideális gáz entrópiájáról szóló feladatban]] kapott entrópia-kifejezést, tegyük fel, hogy a teljes edényt kitöltő két gáz mindegyikének entrópiája úgy számítható, mintha a másik nem lenne jelen, és használjuk fel a Dalton-törvényt.}}{{Végeredmény|content=$$\Delta S = R n_1 \ln\frac{n_1+n_1}{n_1} + R n_2 \ln\frac{n_1+n_2}{n_2}$$}}</wlatex></includeonly> |
| − | #* c) Számítsuk ki az entrópia-változást, ha a két edényben azonos gáz van!</wlatex><includeonly><wlatex>{{Útmutatás|content=A levezetésnél vegyük figyelembe, hogy a keverés utáni állapotban az egész edényben ''ugyanaz'' a gáz van. A különböző gázokra levezetett fenti összefüggésből nem kapunk helyes eredményt; ez a Gibbs-féle paradoxon.}}</wlatex><wlatex>{{Végeredmény|content=$$\Delta S=0$$}}</wlatex></includeonly><noinclude> | + | #* c) <wlatex>Számítsuk ki az entrópia-változást, ha a két edényben azonos gáz van!</wlatex><includeonly><wlatex>{{Útmutatás|content=A levezetésnél vegyük figyelembe, hogy a keverés utáni állapotban az egész edényben ''ugyanaz'' a gáz van. A különböző gázokra levezetett fenti összefüggésből nem kapunk helyes eredményt; ez a Gibbs-féle paradoxon.}}</wlatex><wlatex>{{Végeredmény|content=$$\Delta S=0$$}}</wlatex></includeonly><noinclude> |
| + | |||
== Megoldás == | == Megoldás == | ||
<wlatex>Megoldás szövege | <wlatex>Megoldás szövege | ||
</wlatex> | </wlatex> | ||
</noinclude> | </noinclude> | ||
A lap 2013. április 13., 20:29-kori változata
| Navigáció Pt·1·2·3 |
|---|
| Kísérleti fizika 3. gyakorlat |
| Gyakorlatok listája: |
| Entrópia, II. főtétel |
Feladatok listája:
|
| © 2012-2013 BME-TTK, TÁMOP4.1.2.A/1-11/0064 |
Feladat
- Egymástól válaszfallal elzárt,
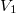 és
és 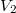 térfogatú két edényben azonos hőmérsékletű, azonos nyomású,
térfogatú két edényben azonos hőmérsékletű, azonos nyomású, 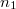 és
és 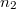 mólszámú, különböző fajtájú ideális gáz van. Ha a válaszfalat eltávolítjuk, akkor a két gáz összekeveredik.
mólszámú, különböző fajtájú ideális gáz van. Ha a válaszfalat eltávolítjuk, akkor a két gáz összekeveredik.
- a) Indokoljuk meg, hogy a folyamatban miért nem változik a hőmérséklet és a nyomás!
- b) Határozzuk meg az entrópia-változást (az ún. keverési entrópiát), és fejezzük ki a gázok
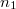 és
és 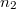 mólszámaival!
mólszámaival!
- c) Számítsuk ki az entrópia-változást, ha a két edényben azonos gáz van!
Megoldás
Megoldás szövege