Termodinamika példák - Keveredési entrópia, Gibbs-paradoxon
| Navigáció Pt·1·2·3 |
|---|
| Kísérleti fizika 3. gyakorlat |
| Gyakorlatok listája: |
| Entrópia, II. főtétel |
Feladatok listája:
|
| © 2012-2013 BME-TTK, TÁMOP4.1.2.A/1-11/0064 |
Feladat
- Egymástól válaszfallal elzárt,
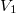 és
és 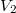 térfogatú két edényben azonos hőmérsékletű, azonos nyomású,
térfogatú két edényben azonos hőmérsékletű, azonos nyomású, 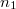 és
és 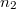 mólszámú, különböző fajtájú ideális gáz van. Ha a válaszfalat eltávolítjuk, akkor a két gáz összekeveredik.
mólszámú, különböző fajtájú ideális gáz van. Ha a válaszfalat eltávolítjuk, akkor a két gáz összekeveredik.
- a) Indokoljuk meg, hogy a folyamatban miért nem változik a hőmérséklet és a nyomás!
- b) Határozzuk meg az entrópia-változást (az ún. keverési entrópiát), és fejezzük ki a gázok
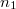 és
és 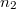 mólszámaival!
mólszámaival!
- c) Számítsuk ki az entrópia-változást, ha a két edényben azonos gáz van!
Megoldás
a)A két edény paramétereit alsó indexek számokkal (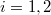 ), a gázokat betűkkel (
), a gázokat betűkkel (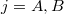 ) különböztetjük meg. Kezdetben az állapotegyenlet:
) különböztetjük meg. Kezdetben az állapotegyenlet:
![\[ p V_1= N_1kT \]](/images/math/e/7/a/e7af70f99945aec2efc14d1d607ce5b2.png)
![\[ p V_2= N_2kT \]](/images/math/1/7/b/17b583d4463edfc4c6e843488bf14557.png)
A fal elvétele után a Dalton-törvényt felhasználva a kialakuló parciális nyomások:
![\[ p_A=\frac{N_1kT}{V_1+ V_2}\]](/images/math/7/5/5/7552e96b6db127e12b0c4c7f97107856.png)
![\[ p_B=\frac{N_2kT}{V_1+ V_2}\]](/images/math/c/8/f/c8fac92296cb430acc932e299375976a.png)
és a 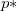 össznyomás
össznyomás
![\[\]](/images/math/b/8/3/b83fa70287c65f9e336c48e0eb4ff152.png)
b) Az I. főtételt kiintegrálva korábban kaptuk, hogy:
\[ \Delta S_j = n_j C_{Vj} \ln \frac{V_{j\text{veg}}}{V_{j\text{kezd}} +n_j R \ln \frac{V_{j\text{veg}}}{V_{j\text{kezd}} \]
Ezzel a két gáz entrópia-változásának összege:
![\[\Delta S=R\left( n_1\ln \frac{V_1+ V_2}{V_1}+ n_2\ln \frac{V_1+ V_2}{V_2}\right)\]](/images/math/c/1/6/c16768e0bc9a71300b35e36b13adaac1.png)
![\[ V_1=\frac{n_1RT} p \]](/images/math/7/f/d/7fd9b457330174aa9760601c493a8bee.png)
![\[ V_2=\frac{n_2RT} p\]](/images/math/3/6/8/36818b40a31772129b8619d49f16f887.png)
![\[\]](/images/math/b/8/3/b83fa70287c65f9e336c48e0eb4ff152.png)
c)
Ha azonos gáz van mindkét tartályban, akkor azt várnánk, hogy 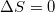 , viszont az előbbi összeg mindkét tagja nagyobb nullánál. A Boltzmann-féle entrópiával számolva:
, viszont az előbbi összeg mindkét tagja nagyobb nullánál. A Boltzmann-féle entrópiával számolva:
Az első tartályt p, a másodikat q darab cellára osztjuk fel, amelyekben rendre N'_1, N'_2, …, N'_p, N'_{p+1</sub>, …, N'p+q részecske van. Ezt a makroállapotot a fal elvétele előtt W1}-féle mikroállapot valósíthatja meg. Az N_1+N_2 darab részecskét – mivel azok azonos fajtájúak – a két edényben rendelkezésre álló N_1+N_2 helyükre 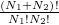 -féleképpen oszthatjuk szét. Majd ezeket az adott edényükben levő cellákban is szét kell osztanunk:
-féleképpen oszthatjuk szét. Majd ezeket az adott edényükben levő cellákban is szét kell osztanunk:
![\[ W_1=\frac{\left( N_1+ N_2\right)!}{N_1! N_2!}\cdot \frac{N_1!}{\prod _{i=1}^pN{\,\mathrm '}_i!}\cdot \frac{N_2!}{\prod _{i=p+1}^{p+q}N{\,\mathrm '}_i!}=\frac{\left( N_1+ N_2\right)!}{\prod _{i=1}^{p+q}N{\,\mathrm '}_i!}\]](/images/math/e/c/1/ec1ec0983d305deea24c868889b6f102.png)
A fal felnyitását követően is osszuk fel az egybenyitott edényeket az előbbi makroállapotnak megfelelően (N'_1, …, N'_{p+q}). Ekkor a W_2 termodinamikai valószínűség:
![\[ W_2=\frac{\left( N_1+ N_2\right)!}{\prod _{i=1}^{p+q}N{\,\mathrm '}_i!}\]](/images/math/e/e/e/eee851cc59deaad2ce354542020aed97.png)
Ezekkel a Boltzmann-féle entrópia:
![\[\Delta S=k\ln \frac{W_2}{W_1}=0\]](/images/math/7/8/1/7815bea5590b537ef01e2ae414123632.png)
Ha kezdetben a két edényben különböző gázok volnának, akkor W_1-ben az 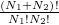 tag eltűnne, hiszen csak egyféleképpen tudnánk szétosztani a részecskéket a tartályok között. Ekkor:
tag eltűnne, hiszen csak egyféleképpen tudnánk szétosztani a részecskéket a tartályok között. Ekkor:
![\[\Delta S=k\ln \frac{W_2}{W_1}=k\ln \frac{\left( N_1+ N_2\right)!}{N_1! N_2!}\]](/images/math/3/b/b/3bb3e2eb605780b392f47ae1c1de566b.png)
Az 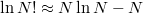 Stirling-formulát felhasználva a b)-beli összefüggést kapjuk vissza.
Stirling-formulát felhasználva a b)-beli összefüggést kapjuk vissza.