Termodinamika példák - Van der Waals-gáz egyensúlyi hőmérséklete
A Fizipedia wikiből
Feladat
- Van der Waals-gázok belső energiájának térfogatfüggése az alábbi összefüggéssel adható meg: ahol
![\[ U = c_V mT - \frac{m^2}{M^2}\frac{a}{V},\]](/images/math/b/4/7/b47f383e5a17bd995a4937b18f1989c8.png)
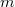 a gáz tömege,
a gáz tömege, 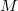 a móltömeg,
a móltömeg, 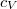 az állandó térfogaton mért fajhő,
az állandó térfogaton mért fajhő,  állandó.
állandó.
Egy hőszigetelt tartályt rögzített, jó hővezető anyagból készített fal választ két részre, amelyekbe azonos tömegű Van der Waals-gázt vezettünk be. A kezdeti állapotjellemzők: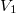 ,
, 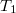 , illetve
, illetve 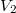 ,
, 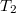 .
.
- a) Mennyi lesz a végső egyensúlyi hőmérséklet?
- b) Hogyan módosul a válasz, ha a gáz betöltése után az elválasztó falat rögtön kivesszük?
Megoldás
Az egész tartályt tekintve az összes 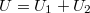 belső energia állandó.
belső energia állandó.
a) A hővezető fal megőrzi az egyes rekeszek térfogatát, de megengedi köztük a hőcserét, így a közös hőmérséklet kialakulását:
![\[ c_V m T_1-\frac{m^2}{M^2}\frac{a}{V_1} + c_V m T_2-\frac{m^2}{M^2} \frac{a}{V_2} = c_V m T-\frac{m^2}{M^2}\frac{a}{V_1} + c_V m T-\frac{m^2}{M^2} \frac{a}{V_2}. \]](/images/math/f/9/2/f92c46aca4335b8f482c1f97e8a36958.png)
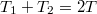 , azaz a közös hőmérséklet
, azaz a közös hőmérséklet ![\[ T=\frac{T_1+T_2}{2}. \]](/images/math/e/8/8/e888622cbe8c1ae38e270a3573766a02.png)
b) Ha kivesszük a válaszfalat, a gáz sűrűsége mindkét rekeszben azonos lesz, a végállapotban a 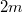 tömegű gáz a
tömegű gáz a 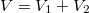 térfogatot tölti ki:
térfogatot tölti ki:
![\[ c_V m T_1-\frac{m^2}{M^2}\frac{a}{V_1} + c_V m T_2-\frac{m^2}{M^2} \frac{a}{V_2} = c_V 2m T-\frac{(2m)^2}{M^2}\frac{a}{V_1+ V_2}.\]](/images/math/a/e/c/aecb5b38af848396f968062a6eb3c47b.png)
Egyszerűsítések
![\[ T_1+ T_2-\frac{ma}{c_V M^2}\left(\frac 1{V_1}+\frac 1{V_2}\right) = 2T-\frac{ma}{c_V M^2}\left(\frac 4{V_1+ V_2}\right), \]](/images/math/6/5/e/65ef850d68946d0c3c3c0abae5ea6fb3.png)
és közös nevezőre hozás után a közös hőmérséklet
![\[ T=\frac{T_1+ T_2} 2-\frac{ma}{2 c_V M^2}\cdot \frac{{\left( V_2- V_1\right)}^2}{\left( V_1+ V_2\right) V_1 V_2}. \]](/images/math/b/0/0/b005428ee1e4b89d170138b87cb53142.png)