Termodinamika példák - Ideális gáz entrópiája
| [rejt] Navigáció Pt·1·2·3 |
|---|
| Kísérleti fizika 3. gyakorlat |
| Gyakorlatok listája: |
| Entrópia, II. főtétel |
| Feladatok listája: |
| © 2012-2013 BME-TTK, TÁMOP4.1.2.A/1-11/0064 |
Feladat
- Az ideális gáz entrópiáját gyakran az
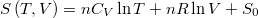 alakban használják.
alakban használják.
- a) Indokolja meg, hogy az
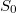 mennyiségnek függnie kell a rendszer anyagmennyiségét megadó
mennyiségnek függnie kell a rendszer anyagmennyiségét megadó 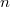 mólszámtól!
mólszámtól!
- b) Adjon meg egy olyan
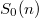 -függést, amellyel az entrópia fenti kifejezése teljesíti az a) pontban szereplő követelményt!
-függést, amellyel az entrópia fenti kifejezése teljesíti az a) pontban szereplő követelményt!
- a) Indokolja meg, hogy az
Megoldás
a) Az entrópia extenzív mennyiség, ezért egy nagyobb rendszer entrópiája az őt alkotó (őt hiánytalanul tartalmazó, de diszjunkt) részrendszerek entrópiájának összege. Ez az additivitás csak úgy teljesülhet, ha az 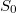 referenciaérték függ a rendszer nagyságától, azaz a mólszámtól.
referenciaérték függ a rendszer nagyságától, azaz a mólszámtól.
Megjegyzés
A feladatban megadott képletben 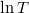 és
és 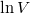 csak dimenzió nélkül (előre rögzített
csak dimenzió nélkül (előre rögzített 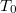 és
és 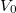 egységekben mért mértékegység nélküli számként) értelmezhetőek, ahogy az előző feladatban megállapítottuk:
egységekben mért mértékegység nélküli számként) értelmezhetőek, ahogy az előző feladatban megállapítottuk:
![\[ S\left(T,V,n\right) - S_0(n) = n \left( C_V \ln T + R\ln V \right). \]](/images/math/4/a/f/4afbc10ae4e896a5e4172e081b4b00f9.png)
b) Mivel az entrópia extenzív mennyiség, egyensúlyban felírható olyan tagokból, melyek pontosan egy extenzív mennyiséget (pl. mólszám) és intenzív mennyiségek függvényeit tartalmazzák. Intenzívnek tekintendőek a moláris- és sűrűségjellegű mennyiségek is.
Tegyük a térfogatot is molárissá, így leválaszthatjuk a mólszámtól való függést:
![\[ S\left(T,V,n\right) = n\left( C_V \ln T + R\ln \frac{V}{n} + R\ln n +\frac{S_0(n)}{n} \right) = n\left( C_V \ln T + R\ln V_M + s_0 \right), \]](/images/math/e/4/b/e4b84fa24b405361acf517f93bfdba05.png)
ahol a zárójelben intenzív mennyiségek állnak: 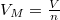 moláris térfogat és
moláris térfogat és 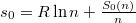 már függetlenek a mólszámtól, és beazonosíthatjuk, hogy
már függetlenek a mólszámtól, és beazonosíthatjuk, hogy
![\[ S_0(n)=-nR\ln n+ns_0. \]](/images/math/b/1/d/b1dc646b453328d8e2956b16892eeb32.png)