„Termodinamika példák - Gázcsere tartályok közt” változatai közötti eltérés
a |
|||
| 5. sor: | 5. sor: | ||
{{Kísérleti fizika gyakorlat | {{Kísérleti fizika gyakorlat | ||
| tárgynév = Kísérleti fizika 3. gyakorlat | | tárgynév = Kísérleti fizika 3. gyakorlat | ||
| − | |||
| − | |||
| témakör = Termodinamika - Kinetikus gázelmélet, transzportfolyamatok | | témakör = Termodinamika - Kinetikus gázelmélet, transzportfolyamatok | ||
| előző = Termodinamika - Állapotváltozás, I. főtétel | | előző = Termodinamika - Állapotváltozás, I. főtétel | ||
| következő = Termodinamika - Állapotváltozás, I. főtétel | | következő = Termodinamika - Állapotváltozás, I. főtétel | ||
| − | |||
| − | |||
}} | }} | ||
== Feladat == | == Feladat == | ||
| − | </noinclude><wlatex># Két azonos térfogatú tartály kacsolódik egymáshoz, a szabad úthosszhoz képest kisméretű nyíláson keresztül. Az egyikben $p_K$ nyomású hidrogéngáz, a másikban kétszer akkora nyomású hidrogéngáz van. A gázok $T$ hőmérséklete azonos és időben állandó. A kinetikus gázelmélet segítségével mutassuk ki, hogy a két tartályban azonos $p=3p_K/2$ egyensúlyi nyomás alakul ki!</wlatex><includeonly><wlatex>{{Útmutatás|content=Használjuk ki, hogy egyensúlyban az egyes edényekben a | + | </noinclude><wlatex># Két azonos térfogatú tartály kacsolódik egymáshoz, a szabad úthosszhoz képest kisméretű nyíláson keresztül. Az egyikben $p_K$ nyomású hidrogéngáz, a másikban kétszer akkora nyomású hidrogéngáz van. A gázok $T$ hőmérséklete azonos és időben állandó. A kinetikus gázelmélet segítségével mutassuk ki, hogy a két tartályban azonos $p=3p_K/2$ egyensúlyi nyomás alakul ki!</wlatex><includeonly><wlatex>{{Útmutatás|content=Használjuk ki, hogy egyensúlyban az egyes edényekben a molekulák térfogati sűrűsége állandó, és az összes molekulák száma a folyamatban nem változik.}}</wlatex></includeonly><noinclude> |
== Megoldás == | == Megoldás == | ||
<wlatex>Amikor a gázcsere kis lyukon keresztül valósul meg a tartályok között, feltehetjük, hogy a gáz egy-egy tartályon belül végig egyensúlyi állapotban marad. Ha a lyuk mérete kisebb az átlagos szabad úthossznál, akkor a rajta keresztül időegység alatt távozó molekulák száma pedig megegyezik azzal, az azonos méretű tartályfalának ütközik egységnyi idő alatt. A molekulák száma az egyes tartályokban időben változik, ezt általánosan differenciálegyenlet-rendszerrel írhatjuk le: | <wlatex>Amikor a gázcsere kis lyukon keresztül valósul meg a tartályok között, feltehetjük, hogy a gáz egy-egy tartályon belül végig egyensúlyi állapotban marad. Ha a lyuk mérete kisebb az átlagos szabad úthossznál, akkor a rajta keresztül időegység alatt távozó molekulák száma pedig megegyezik azzal, az azonos méretű tartályfalának ütközik egységnyi idő alatt. A molekulák száma az egyes tartályokban időben változik, ezt általánosan differenciálegyenlet-rendszerrel írhatjuk le: | ||
A lap 2013. április 2., 21:20-kori változata
| [rejt] Navigáció Pt·1·2·3 |
|---|
| Kísérleti fizika 3. gyakorlat |
| Gyakorlatok listája: |
| Termodinamika - Kinetikus gázelmélet, transzportfolyamatok |
| Feladatok listája: |
| © 2012-2013 BME-TTK, TÁMOP4.1.2.A/1-11/0064 |
Feladat
- Két azonos térfogatú tartály kacsolódik egymáshoz, a szabad úthosszhoz képest kisméretű nyíláson keresztül. Az egyikben
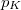 nyomású hidrogéngáz, a másikban kétszer akkora nyomású hidrogéngáz van. A gázok
nyomású hidrogéngáz, a másikban kétszer akkora nyomású hidrogéngáz van. A gázok  hőmérséklete azonos és időben állandó. A kinetikus gázelmélet segítségével mutassuk ki, hogy a két tartályban azonos
hőmérséklete azonos és időben állandó. A kinetikus gázelmélet segítségével mutassuk ki, hogy a két tartályban azonos 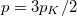 egyensúlyi nyomás alakul ki!
egyensúlyi nyomás alakul ki!
Megoldás
Amikor a gázcsere kis lyukon keresztül valósul meg a tartályok között, feltehetjük, hogy a gáz egy-egy tartályon belül végig egyensúlyi állapotban marad. Ha a lyuk mérete kisebb az átlagos szabad úthossznál, akkor a rajta keresztül időegység alatt távozó molekulák száma pedig megegyezik azzal, az azonos méretű tartályfalának ütközik egységnyi idő alatt. A molekulák száma az egyes tartályokban időben változik, ezt általánosan differenciálegyenlet-rendszerrel írhatjuk le:
![\[ \frac{\mathrm{d}N^{(1)}}{\mathrm{d}t} = - \frac14 n_V^{(1)}\langle v \rangle A + \frac14 n_V^{(2)}\langle v \rangle A,\]](/images/math/b/3/4/b347c9f105aeb903ab882413b764b9f2.png)
a molekulák átlagos sebessége 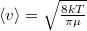 érelmében azonos, hiszen a két tartály hőmérséklete és töltőanyaga is azonos.
érelmében azonos, hiszen a két tartály hőmérséklete és töltőanyaga is azonos.
Az anyagmegmaradás értelmében a második tartályban levő molekulák száma 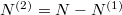 , aminek értelmében
, aminek értelmében 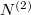 megváltozása is kifejezhető az előző mennyiségekkel:
megváltozása is kifejezhető az előző mennyiségekkel:
![\[ \frac{\mathrm{d}N^{(1)}}{\mathrm{d}t} = -\frac{\mathrm{d}N^{(2)}}{\mathrm{d}t}. \]](/images/math/1/6/c/16c0565dd0bb4bb61f994f9bde059e3a.png)
Felhasználva ezt és, hogy 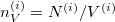 , ismét szétválasztható differenciálegyenletet kapunk:
, ismét szétválasztható differenciálegyenletet kapunk:
![\[ V^{(1)} \frac{\mathrm{d}n^{(1)}}{\mathrm{d}t} = - \frac14 \langle v \rangle A \left(1+\frac{V^{(1)}}{V^{(2)}}\right)n^{(1)} + \frac14 \langle v \rangle A \frac{N}{V^{(2)}}\]](/images/math/8/9/9/89916c699d6c1f63bcd0db3b76b29c24.png)
Egyensúly esetén 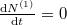 , azaz
, azaz 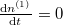 :
:
![\[ \left(1+\frac{V^{(1)}}{V^{(2)}}\right)n^{(1)} = \frac{N}{V^{(2)}},\]](/images/math/9/4/4/944fc3cdf75243ec53be80a78c11e0e5.png)
amiből
![\[ n^{(1)} = \frac{N}{V^{(1)}+V^{(2)}}. \]](/images/math/4/6/e/46e60bca8a2d19c64ece7d41bbd769da.png)
Analóg módon kapjuk, hogy 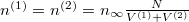 , azaz a két tartályban megegyezik a gáz sűrűsége, a feladatkiírás szerint hőmérséklete is, így nyomása
, azaz a két tartályban megegyezik a gáz sűrűsége, a feladatkiírás szerint hőmérséklete is, így nyomása 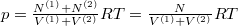 .
.
Speciálisan a feladat szerint 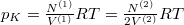 és
és 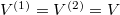 , azaz
, azaz 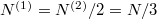 , ezeket összevetve a kialakuló egyensúlyi nyomás
, ezeket összevetve a kialakuló egyensúlyi nyomás 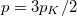 .
.
Kiegészítés
A felírt
![\[ \frac{\mathrm{d}n^{(1)}}{\mathrm{d}t} = - \alpha n^{(1)} + \beta,\]](/images/math/0/0/9/0093fcfedfb0688f24b54240b2d2fb7c.png)
![\[ \alpha = \frac14 \langle v \rangle A \left(\frac{V^{(1)}+V^{(2)}}{V^{(1)} V^{(2)}}\right), \qquad \beta = \frac14 \langle v \rangle A \frac{N}V^{(1)} {V^{(2)}} = n_\infty \alpha \]](/images/math/7/6/9/7692050dfcf66eb15a73fcc0782082c1.png)
differenciálegyenlet megoldása
![\[ \frac{\mathrm{d}n^{(1)}}{\mathrm{d}t} = \frac{\mathrm{d}(n^{(1)}-n_\infty)}{\mathrm{d}t} - \alpha n^{(1)} + \alpha (n^{(1)}-n_\infty)\]](/images/math/d/f/2/df258a3878253ca6356b7d06f70e8c76.png)
felírásban már triviális:
![\[ n^{(1)}-n_\infty = c \, e^{ -\alpha t }, \]](/images/math/2/7/1/271c17c52e79dda402da39958ac6fe9a.png)
aminek kezdeti feltétele 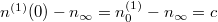 .
Az első tartályban levő részecskék száma exponenciálisan lecsengve közelít az egyensúlyi
.
Az első tartályban levő részecskék száma exponenciálisan lecsengve közelít az egyensúlyi 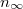 értékhez:
értékhez:
![\[ n^{(1)} = n_\infty + (n^{(1)}_0-n_\infty) e^{ -\alpha t }. \]](/images/math/0/2/2/022697e74f38cc85bfce46d459ad1d18.png)
Diszkusszió
Ha 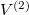 térfogatot végtelennek tekintjük, akkor a gáz szökésének speciális esetét kapjuk:
térfogatot végtelennek tekintjük, akkor a gáz szökésének speciális esetét kapjuk: 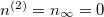 :
:
![\[ n^{(1)} = n^{(1)}_0 e^{ -\alpha t }. \]](/images/math/c/2/1/c21c8817bafa78f1b867e5f3dc8221fa.png)