„Termodinamika példák - Gázcsere két gázzal” változatai közötti eltérés
| 20. sor: | 20. sor: | ||
= \frac14 \langle v_O \rangle A \left(n_{VO}^{(2)}-n_{VO}^{(2)}\right),$$ | = \frac14 \langle v_O \rangle A \left(n_{VO}^{(2)}-n_{VO}^{(2)}\right),$$ | ||
a molekulák átlagos sebessége $\langle v \rangle = \sqrt{\frac{8kT}{\pi \mu }}$ fordítottan arányos a $\mu$ molekulatömeggel (a két tartály | a molekulák átlagos sebessége $\langle v \rangle = \sqrt{\frac{8kT}{\pi \mu }}$ fordítottan arányos a $\mu$ molekulatömeggel (a két tartály | ||
| − | hőmérséklete) azonos: $\mu_{H_2}=2 \mathrm{\frac{g}{mol}}$, $\mu_{O_2}=32 \mathrm{\frac{g}{mol}}$. | + | hőmérséklete) azonos: $\mu_{H_2}=2 \mathrm{\frac{g}{mol}}$, $\mu_{O_2}=32 \mathrm{\frac{g}{mol}}$. Az anyagmegmaradás következtében a 2. tartály tartalmát nem kell külön számon tartanunk. |
Legyen kezdetben az 1. tartályban a hidrogén és a másodikban az oxigén: | Legyen kezdetben az 1. tartályban a hidrogén és a másodikban az oxigén: | ||
| 28. sor: | 28. sor: | ||
Egyensúlyban $\frac{\mathrm{d}N^{(1)}_H}{\mathrm{d}t}=0$, azaz $n_{VH\text{vég}}^{(1)}=n_{VH\text{vég}}^{(2)}=n_{VH\text{vég}}$. | Egyensúlyban $\frac{\mathrm{d}N^{(1)}_H}{\mathrm{d}t}=0$, azaz $n_{VH\text{vég}}^{(1)}=n_{VH\text{vég}}^{(2)}=n_{VH\text{vég}}$. | ||
| − | Az anyagmegmaradás értelmében $N_H^{(2)}=N_H-N_H^{(1)}$, aminek | + | Az anyagmegmaradás értelmében $N_H^{(2)}=N_H-N_H^{(1)}$, aminek következtében: |
$$ V^{(1)} n_{VH} = V^{(1)} n_{VH}^{(1)} + V^{(2)} n_{VH}^{(2)} = n_{VH\text{vég}} \left( V^{(1)} + V^{(2)} \right), $$ | $$ V^{(1)} n_{VH} = V^{(1)} n_{VH}^{(1)} + V^{(2)} n_{VH}^{(2)} = n_{VH\text{vég}} \left( V^{(1)} + V^{(2)} \right), $$ | ||
az előző összefüggést behelyettesítve a hidrogénre | az előző összefüggést behelyettesítve a hidrogénre | ||
A lap 2013. április 3., 00:42-kori változata
| [rejt] Navigáció Pt·1·2·3 |
|---|
| Kísérleti fizika 3. gyakorlat |
| Gyakorlatok listája: |
| Termodinamika - Kinetikus gázelmélet, transzportfolyamatok |
| Feladatok listája: |
| © 2012-2013 BME-TTK, TÁMOP4.1.2.A/1-11/0064 |
Feladat
- Két azonos térfogatú tartály kacsolódik egymáshoz, a szabad úthosszhoz képest kisméretű nyíláson keresztül. Az egyikben
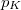 nyomású hidrogéngáz, a másikban kétszer akkora nyomású oxigéngáz van. A gázok
nyomású hidrogéngáz, a másikban kétszer akkora nyomású oxigéngáz van. A gázok  hőmérséklete azonos és időben állandó. A kinetikus gázelmélet segítségével mutassuk ki, hogy a két tartályban azonos
hőmérséklete azonos és időben állandó. A kinetikus gázelmélet segítségével mutassuk ki, hogy a két tartályban azonos 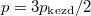 egyensúlyi nyomás alakul ki!
egyensúlyi nyomás alakul ki!
Megoldás
Amikor a gázcsere kis lyukon keresztül valósul meg a tartályok között, feltehetjük, hogy a gáz egy-egy tartályon belül végig egyensúlyi állapotban marad. Ha a lyuk mérete kisebb az átlagos szabad úthossznál, akkor a rajta keresztül időegység alatt távozó molekulák száma pedig megegyezik azzal, az azonos méretű tartályfalának ütközik egységnyi idő alatt. Az ideális gáz közelítésben a két gáz molekulái sem saját fajtájukkal, sem a másik géázzal nem hatnak kölcsön, ezért külön differenciálegyenleteket írhatunk fel az egyes gázokra:
![\[ \frac{\mathrm{d}N^{(1)}_H}{\mathrm{d}t} = - \frac14 n_{VH}^{(1)}\langle v_H \rangle A + \frac14 n_{VH}^{(2)}\langle v_H \rangle A = \frac14 \langle v_H \rangle A \left(n_{VH}^{(2)}-n_{VH}^{(2)}\right),\]](/images/math/f/5/3/f530ded956006017d2c13b197cbe6fcf.png)
![\[ \frac{\mathrm{d}N^{(1)}_O}{\mathrm{d}t} = - \frac14 n_{VO}^{(1)}\langle v_O \rangle A + \frac14 n_{VO}^{(2)}\langle v_O \rangle A = \frac14 \langle v_O \rangle A \left(n_{VO}^{(2)}-n_{VO}^{(2)}\right),\]](/images/math/2/d/4/2d47710c058f120beef81e935f4ca145.png)
a molekulák átlagos sebessége 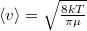 fordítottan arányos a
fordítottan arányos a 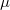 molekulatömeggel (a két tartály
hőmérséklete) azonos:
molekulatömeggel (a két tartály
hőmérséklete) azonos: 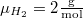 ,
, 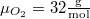 . Az anyagmegmaradás következtében a 2. tartály tartalmát nem kell külön számon tartanunk.
. Az anyagmegmaradás következtében a 2. tartály tartalmát nem kell külön számon tartanunk.
Legyen kezdetben az 1. tartályban a hidrogén és a másodikban az oxigén:
![\[ n_{VH\text{kezd}}^{(1)} = n_{VH\text{kezd}}, \qquad n_{VH\text{kezd}}^{(2)}=0, \]](/images/math/2/c/3/2c36e36f23703b17caaa11226c07dbb6.png)
![\[ n_{VO\text{kezd}}^{(2)} = n_{VO\text{kezd}}, \qquad n_{VO\text{kezd}}^{(1)}=0. \]](/images/math/7/2/0/72055b6b0f0ef23490ff662122848289.png)
Egyensúlyban 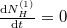 , azaz
, azaz 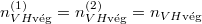 .
.
Az anyagmegmaradás értelmében 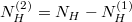 , aminek következtében:
, aminek következtében:
![\[ V^{(1)} n_{VH} = V^{(1)} n_{VH}^{(1)} + V^{(2)} n_{VH}^{(2)} = n_{VH\text{vég}} \left( V^{(1)} + V^{(2)} \right), \]](/images/math/a/c/f/acf714739e957d1481ab258a52cfbcf2.png)
az előző összefüggést behelyettesítve a hidrogénre
![\[ n_{VH\text{vég}} = \frac{V^{(1)}}{V^{(1)} + V^{(2)}} n_{VH\text{kezd}} \]](/images/math/7/a/e/7ae3443aaaa25fd869ef3e4e7035c703.png)
és analóg módon az oxigénre
![\[ n_{VO\text{vég}} = \frac{V^{(2)}}{V^{(1)} + V^{(2)}} n_{VO\text{kezd}} \]](/images/math/5/e/0/5e0bac81482018178da1fd813e97bda3.png)
adódik.
A kezdeti 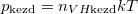 és
és 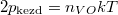 nyomásokból
nyomásokból 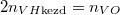 összefüggést nyerjük.
A kialakuló
összefüggést nyerjük.
A kialakuló
![\[p_{O\text{vég}} = n_{VO\text{vég}}kT = \frac{V^{(2)}}{V^{(1)}+V^{(2)}} 2p_\text{kezd}\]](/images/math/a/4/8/a48ffdcb5d7bd986f3b78d4907097cf6.png)
és
![\[p_{H\text{vég}} = n_{VH\text{vég}}kT = \frac{V^{(1)}}{V^{(1)}+V^{(2)}} p_\text{kezd}\]](/images/math/f/4/6/f462b95403e67c1cdc59ac7740001196.png)
nyomásokból pedig a parciális nyomások tétele szerint
![\[p_\text{vég} = p_{H\text{vég}} + p_{O\text{vég}} = \frac{2V^{(2)}}{V^{(1)}+V^{(2)}} + \frac{V^{(1)}}{V^{(1)}+V^{(2)}} p_\text{kezd}\]](/images/math/a/6/f/a6f2f8d627f8620cda7b3b33d3d7586c.png)
adódik.
Speciálisan a feladat szerint 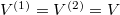 , (továbbá
, (továbbá 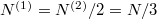 ), ezeket az előző képletbe helyettesítve a kialakuló egyensúlyi nyomás
), ezeket az előző képletbe helyettesítve a kialakuló egyensúlyi nyomás 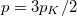 .
.
A részecskeszámokra vonatkozó differenciálegyenletek megoldása az előző feladatéval analóg.