„Termodinamika példák - Térfogatváltozás fajhőviszonnyal” változatai közötti eltérés
A Fizipedia wikiből
(→Megoldás) |
|||
| 21. sor: | 21. sor: | ||
$$ V_2 = V_1 \cdot 2^{\frac{1}{\gamma-1}}$$ | $$ V_2 = V_1 \cdot 2^{\frac{1}{\gamma-1}}$$ | ||
| − | [[Fájl:Ideális gáz térfogatváltozása.svg]] | + | [[Fájl:Ideális gáz térfogatváltozása.svg|400px]] |
</wlatex> | </wlatex> | ||
</noinclude> | </noinclude> | ||
A lap 2013. április 7., 15:51-kori változata
Feladat
- Egy kezdetben
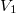 térfogatú,
térfogatú, 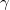 fajhőviszonyú ideális gáz térfogatát
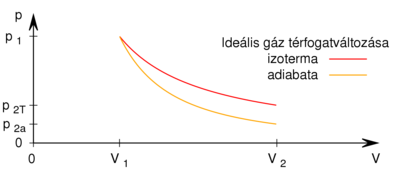
fajhőviszonyú ideális gáz térfogatát 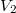 -re növeljük. A folyamatot egyszer adiabatikusan, másodszor pedig izotermikusan hajtjuk végre. Az első és második végállapotban a nyomások aránya
-re növeljük. A folyamatot egyszer adiabatikusan, másodszor pedig izotermikusan hajtjuk végre. Az első és második végállapotban a nyomások aránya 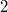 . Mekkora a
. Mekkora a 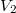 térfogat?
térfogat?
Megoldás
Azonos kezdeti feltételekből izoterm állapotváltozás során
![\[ p_1 V_1 = p_{2\text{T}} V_2 \]](/images/math/a/5/a/a5a66c3fbf0a42b787c99a18f6ebbf45.png)
míg adiabatikusan
![\[ p_1 V_1^\gamma = p_{2\text{ad}} V_2^\gamma. \]](/images/math/4/5/8/4586ba149c481541b21d8195f02bd026.png)
A két egyenletet egymással elosztva
![\[ V_1^{\gamma-1} = \frac{p_{2\text{ad}}}{p_{2\text{T}}} V_2^{\gamma-1}, \]](/images/math/4/c/b/4cb48b4ac50bf60bf5820a17352434cf.png)
\setbox0\hbox{$\frac{p_{2\text{T}}{p_{2\text{ad}}=2$}%
\message{//depth:\the\dp0//}%
\box0%
(táguláskor az 1:2 arány csak ebben az irányban teljesülhet, mert az adiabata meredekebb, mint az izoterma), innen
![\[ V_2 = V_1 \cdot 2^{\frac{1}{\gamma-1}}\]](/images/math/4/1/e/41e43b63a6e8a9ed8458982dd7aceeb1.png)