„Termodinamika - Kinetikus gázelmélet, transzportfolyamatok” változatai közötti eltérés
A Fizipedia wikiből
(→Ismert összefüggések) |
(→Ismert összefüggések) |
||
| 14. sor: | 14. sor: | ||
$$F(v)=A \left(\frac{v}{v_0}\right)^2 \exp\left\{ -\left(\frac{v}{{v}_{0}}\right)^2 \right\}$$ | $$F(v)=A \left(\frac{v}{v_0}\right)^2 \exp\left\{ -\left(\frac{v}{{v}_{0}}\right)^2 \right\}$$ | ||
alakú valószínűségi sűrűségfüggvény, $v_0$ a legvalószínűbb sebesség és $A=\frac{4}{v_0\sqrt{\pi}}$ normáló tényező. | alakú valószínűségi sűrűségfüggvény, $v_0$ a legvalószínűbb sebesség és $A=\frac{4}{v_0\sqrt{\pi}}$ normáló tényező. | ||
| − | |||
Az eloszlásra jellemző sebességek kifejezhetőek a $T$ hőmérséklettel és a $\mu$ a molekulatömeggel: | Az eloszlásra jellemző sebességek kifejezhetőek a $T$ hőmérséklettel és a $\mu$ a molekulatömeggel: | ||
{| style="margin-left: auto; margin-right: auto;" | {| style="margin-left: auto; margin-right: auto;" | ||
| + | | rowspan="3" style="min-width: 250px; text-align: center;" | [[Fájl:Maxwell-sebességeloszlás sémája.svg|200px]] | ||
| align="right" | $v_0$ || = || $\displaystyle \sqrt{\frac{2kT}{\mu}}$ || legvalószínűbb sebesség | | align="right" | $v_0$ || = || $\displaystyle \sqrt{\frac{2kT}{\mu}}$ || legvalószínűbb sebesség | ||
|- | |- | ||
A lap 2013. április 14., 17:21-kori változata
| [rejt] Navigáció Pt·1·2·3 |
|---|
| Kísérleti fizika 3. gyakorlat |
Gyakorlatok listája:
|
| Kinetikus gázelmélet, transzport |
| Feladatok listája: |
| © 2012-2013 BME-TTK, TÁMOP4.1.2.A/1-11/0064 |
Ismert fizikai állandók
![\[ R = N_A \cdot k = 6,02 \cdot 10^{23}\ \mathrm{mol^{-1}} \cdot 1,381 \cdot 10^{-23}\ \mathrm{J \cdot K^{-1}} = 8,314\ \mathrm{J \cdot mol^{-1} \cdot K^{-1}} \]](/images/math/8/0/4/80417d968d780e11850deb51e0928145.png)
ahol 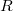 az egyetemes gázálladó,
az egyetemes gázálladó, 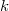 a Boltzmann-állandó,
a Boltzmann-állandó, 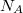 az Avogadro-szám.
az Avogadro-szám.
Ismert összefüggések
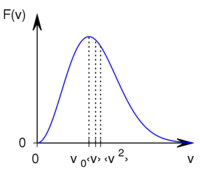
A Maxwell-féle sebességeloszlás
![\[F(v)=A \left(\frac{v}{v_0}\right)^2 \exp\left\{ -\left(\frac{v}{{v}_{0}}\right)^2 \right\}\]](/images/math/b/8/b/b8bc91fba324fff87b547f53a04ee4d0.png)
alakú valószínűségi sűrűségfüggvény, 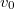 a legvalószínűbb sebesség és
a legvalószínűbb sebesség és 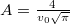 normáló tényező.
Az eloszlásra jellemző sebességek kifejezhetőek a
normáló tényező.
Az eloszlásra jellemző sebességek kifejezhetőek a  hőmérséklettel és a
hőmérséklettel és a 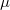 a molekulatömeggel:
a molekulatömeggel:
|
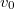 |
= | 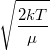 |
legvalószínűbb sebesség |
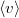 |
= | 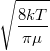 |
sebesség nagyságának átlaga | |
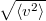 |
= | 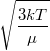 |
sebességnégyzet átlagának gyöke |
Feladatok
- Fejezze ki az egyatomos ideális gáz nyomását a gáz
 belső energiájával és
belső energiájával és  térfogatával!
térfogatával!
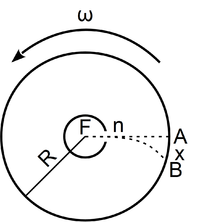
- Stern híres kísérletében, amellyel a Maxwell-eloszlás kísérleti igazolását adta,
 -es ezüstszálról távozó atomok sebességeloszlását mérte meg, az ábrán vázolt elrendezéssel. Az
-es ezüstszálról távozó atomok sebességeloszlását mérte meg, az ábrán vázolt elrendezéssel. Az 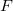 pontbeli tengelyen elhelyezkedő szálról távozó ezüstatomok az
pontbeli tengelyen elhelyezkedő szálról távozó ezüstatomok az 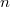 nyíláson át jutottak az
nyíláson át jutottak az 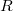 sugarú hengerfelületre. A berendezés
sugarú hengerfelületre. A berendezés  szögsebességgel forgott, aminek következtében a
szögsebességgel forgott, aminek következtében a  sebességű atom az
sebességű atom az 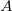 pont helyett
pont helyett 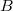 -ben csapódott le.
-ben csapódott le.
- a) Állapítsuk meg az
 ív
ív  hosszát
hosszát 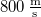 sebességű atomok esetén, ha a fordulatszám
sebességű atomok esetén, ha a fordulatszám 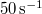 és
és 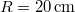 !
!
- b) Milyen sebességnél adják a legnagyobb rétegvastagságot a külső hengerfelületen lecsapódó ezüstatomok?
- a) Állapítsuk meg az
- Az
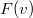 sebességeloszlási függvényből a
sebességeloszlási függvényből a 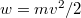 összefüggés felhasználásával vezessük le az
összefüggés felhasználásával vezessük le az 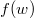 energia-eloszlási függvényt, ahol
energia-eloszlási függvényt, ahol 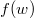 azt mutatja meg, hogy az összes molekula hányadrésze rendelkezik
azt mutatja meg, hogy az összes molekula hányadrésze rendelkezik 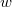 és
és 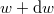 közötti mozgási energiával! Mekkora a legvalószínűbb
közötti mozgási energiával! Mekkora a legvalószínűbb 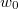 energia és mennyi az átlagos kinetikus energia?
energia és mennyi az átlagos kinetikus energia?
- Legfeljebb mekkora lehet az
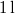 térfogatú, gömb alakú edényben lévő
térfogatú, gömb alakú edényben lévő 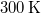 -es hidrogéngáz nyomása, hogy az átlagos szabad úthossz nagyobb legyen az edény átmérőjénél? A hidrogénmolekula átmérője
-es hidrogéngáz nyomása, hogy az átlagos szabad úthossz nagyobb legyen az edény átmérőjénél? A hidrogénmolekula átmérője 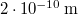 .
.
- Hogyan változik az ideális gáz
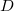 diffúziós állandója és
diffúziós állandója és 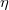 belső súrlódási együtthatója, ha a gáz térfogata
belső súrlódási együtthatója, ha a gáz térfogata 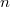 -szersére nő
-szersére nő
- a) állandó hőmérsékleten,
- b) állandó nyomáson?
-
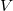 térfogatú, vékonyfalú tartályban ideális gáz van, az edényt légüres tér veszi körül. Feltesszük, hogy a gáz kiáramlása lassú, így a gáz egyensúlyi állapotát a folyamat nem zavarja, továbbá a lyuk mérete sokkal kisebb, mint a szabad úthossz, tehát a lyuk területére is érvényes az az összefüggés, hogy az edény falának időegység alatt nekiütköző molekulák száma
térfogatú, vékonyfalú tartályban ideális gáz van, az edényt légüres tér veszi körül. Feltesszük, hogy a gáz kiáramlása lassú, így a gáz egyensúlyi állapotát a folyamat nem zavarja, továbbá a lyuk mérete sokkal kisebb, mint a szabad úthossz, tehát a lyuk területére is érvényes az az összefüggés, hogy az edény falának időegység alatt nekiütköző molekulák száma 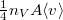 , ahol
, ahol 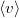 a molekulák átlagsebessége. A hőmérséklet mindvégig
a molekulák átlagsebessége. A hőmérséklet mindvégig  .
.
- a) Hogyan változik az idő függvényében az edényben lévő gáz
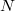 részecskeszáma, ha a tartály falán igen kicsi,
részecskeszáma, ha a tartály falán igen kicsi, 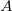 területű lyuk van?
területű lyuk van?
- b) Határozzuk meg azt az időtartamot, amely alatt a gáz nyomása felére csökken!
- a) Hogyan változik az idő függvényében az edényben lévő gáz
- Két azonos térfogatú tartály kapcsolódik egymáshoz, a szabad úthosszhoz képest kisméretű nyíláson keresztül. Az egyikben
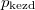 nyomású, a másikban kétszer akkora nyomású hidrogéngáz van. A gázok
nyomású, a másikban kétszer akkora nyomású hidrogéngáz van. A gázok  hőmérséklete azonos és időben állandó. A kinetikus gázelmélet segítségével mutassuk ki, hogy a két tartályban azonos
hőmérséklete azonos és időben állandó. A kinetikus gázelmélet segítségével mutassuk ki, hogy a két tartályban azonos 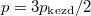 egyensúlyi nyomás alakul ki!
egyensúlyi nyomás alakul ki!
- Két azonos térfogatú tartály kapcsolódik egymáshoz, a szabad úthosszhoz képest kisméretű nyíláson keresztül. Az egyikben
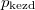 nyomású hidrogéngáz, a másikban kétszer akkora nyomású oxigéngáz van. A gázok
nyomású hidrogéngáz, a másikban kétszer akkora nyomású oxigéngáz van. A gázok  hőmérséklete azonos és időben állandó. A kinetikus gázelmélet segítségével mutassuk ki, hogy a két tartályban azonos
hőmérséklete azonos és időben állandó. A kinetikus gázelmélet segítségével mutassuk ki, hogy a két tartályban azonos 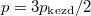 egyensúlyi nyomás alakul ki!
egyensúlyi nyomás alakul ki!
- Egy
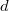 vastagságú, nagy felületű, homogén anyagréteg két ellentétes felületén a hőmérséklet állandó
vastagságú, nagy felületű, homogén anyagréteg két ellentétes felületén a hőmérséklet állandó 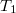 és
és 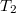 , az anyag hővezetési tényezője hőmérséklet- és helyfüggetlen. A hővezetés alapegyenlete segítségével mutassuk ki, hogy a rétegben a hőmérséklet lineárisan változik az egyik felülettől mért
, az anyag hővezetési tényezője hőmérséklet- és helyfüggetlen. A hővezetés alapegyenlete segítségével mutassuk ki, hogy a rétegben a hőmérséklet lineárisan változik az egyik felülettől mért  távolsággal, és írjuk fel a
távolsággal, és írjuk fel a 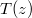 függvényt a megadott mennyiségekkel!
függvényt a megadott mennyiségekkel!
- Mennyi idő alatt képződik
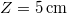 vastag jégréteg egy tó felszínén, ha a léghőmérséklet
vastag jégréteg egy tó felszínén, ha a léghőmérséklet 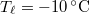 , a víz hőmérséklete a jégréteg alatt
, a víz hőmérséklete a jégréteg alatt 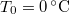 ? Tegyük fel, hogy a jégréteg felső felülete mindig azonos hőmérsékletű a levegővel, alső felülete pedig mindig
? Tegyük fel, hogy a jégréteg felső felülete mindig azonos hőmérsékletű a levegővel, alső felülete pedig mindig 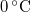 -os. A jég olvadáshője
-os. A jég olvadáshője 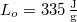 , hővezetési tényezője
, hővezetési tényezője 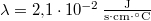 , sűrűsége pedig
, sűrűsége pedig 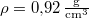 .
.
-
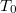 hőmérsékletű, igen nagy hőkapacitású folyadékba
hőmérsékletű, igen nagy hőkapacitású folyadékba 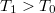 hőmérsékletű,
hőmérsékletű, 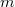 tömegű és
tömegű és  fajhőjű, abszolút jó hővezető testet helyezünk a
fajhőjű, abszolút jó hővezető testet helyezünk a 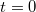 pillanatban. A test lehűlése a Newton-féle lehűlési törvény szerint zajlik (
pillanatban. A test lehűlése a Newton-féle lehűlési törvény szerint zajlik (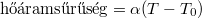 ), az
), az 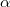 hőátadási tényező ismert, a test felületének nagysága
hőátadási tényező ismert, a test felületének nagysága 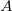 . Határozzuk meg a test hőmérsékletét
. Határozzuk meg a test hőmérsékletét 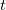 idő eltelte után!
idő eltelte után!
![\[p=\frac{2U}{3V}\]](/images/math/7/9/a/79a5ef5aee3e9a6d7f09326b91f3a4b4.png)
![\[x=\frac{\omega R^2}{v}\]](/images/math/0/b/6/0b64d775cd07f10acdc2f74976361052.png)
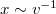 összefüggést.
összefüggést. ![\[v_m=\sqrt{\frac52}\,v_0,\]](/images/math/b/b/e/bbec4f31fa99ad4b348e8f27cca0b017.png)
![\[f(w)=\frac{4}{v_0\sqrt{\pi}}\frac{1}{w_v\sqrt{2\mu}}\sqrt{w} \exp\left\{ -\frac{w}{w_v} \right\}, \text{ ahol } w_v=\frac12 \mu v_0^2=kT\]](/images/math/4/6/e/46ed18cb6e204a14b7d02f1f6f168d50.png)
![\[w_0=\frac12kT,\qquad \langle w\rangle=\frac32kT\]](/images/math/3/a/7/3a7857f15c6a811008e25cebad3e2a36.png)
![\[p<\frac{kT}{2\sqrt{2}\, R \, d^2\pi}=0{,}188\,\mathrm{Pa},\]](/images/math/f/1/3/f13f6dbd41c6c990671c0eb82ccfe194.png)
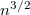 -szeres,
-szeres, 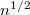 -szeres.
-szeres. ![\[N(t)=n_0\exp\{-t/\tau\},\]](/images/math/0/f/6/0f66732b3648dd5d9e4a439bd08de0d9.png)
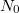 a kezdeti részecskeszám-sűrűség,
a kezdeti részecskeszám-sűrűség, 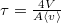 .
. ![\[\tau_{1/2}=\tau \ln 2\]](/images/math/8/9/8/8988e91daa948b7308b8d2c1d7b6f229.png)
![\[T(z)=T_1+\frac{T_2-T_1}{d}z\]](/images/math/b/6/5/b6576fbfcb4cdb76f8702fbc59f78dae.png)
![\[t(Z) = \left(\frac{\rho L_o}{2\lambda(T_0-T_\ell)}\right)\,Z^2, \]](/images/math/d/8/7/d876a0a553d038419a342caf35cbffed.png)
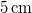 vastag jégréteg.
vastag jégréteg. ![\[T = T_0+\left(T_1-T_0\right)e^{\textstyle -\frac{A\alpha}{cm}t}\]](/images/math/1/3/f/13f20fc241d9d56f3b09002a2987438f.png)