„Termodinamika - Fázisátalakulások” változatai közötti eltérés
A Fizipedia wikiből
| 6. sor: | 6. sor: | ||
| témakör = Termodinamika - Fázisátalakulások | | témakör = Termodinamika - Fázisátalakulások | ||
}} | }} | ||
| + | == Ismert mérési adatok == | ||
| + | {| | ||
| + | | $p_n$ || = || $101,3 \,\mathrm{kPa}$ || normál nyomás | ||
| + | |- | ||
| + | | $M_\text{víz}$ || = || $18{,}01528\mathrm{\frac{g}{mol}}$ || a víz moláris tömege | ||
| + | |- | ||
| + | | $c_\text{víz}$ || = || $4183\mathrm{\frac{J}{kg\,K}}$ || a víz fajhője | ||
| + | |- | ||
| + | | $c_\text{jég}$ || = || $\mathrm{\frac{J}{kg\,K}}$ || a jég fajhője | ||
| + | |- | ||
| + | | $c_\text{vízgőz}$ || = || $\mathrm{\frac{J}{kg\,K}}$ || a vízgőz fajhője | ||
| + | |- | ||
| + | |} | ||
== Feladatok == | == Feladatok == | ||
{{:Termodinamika példák - Átalakulási hő állandó nyomáson}}{{Megoldás|link=Termodinamika példák - Átalakulási hő állandó nyomáson}} | {{:Termodinamika példák - Átalakulási hő állandó nyomáson}}{{Megoldás|link=Termodinamika példák - Átalakulási hő állandó nyomáson}} | ||
A lap 2013. április 18., 15:49-kori változata
| Navigáció Pt·1·2·3 |
|---|
| Kísérleti fizika 3. gyakorlat |
| Gyakorlatok listája: |
| Termodinamika - Fázisátalakulások |
| Feladatok listája: |
| © 2012-2013 BME-TTK, TÁMOP4.1.2.A/1-11/0064 |
Ismert mérési adatok
| $p_n$ | = | $101,3 \,\mathrm{kPa}$ | normál nyomás |
| $M_\text{víz}$ | = | $18{,}01528\mathrm{\frac{g}{mol}}$ | a víz moláris tömege |
| $c_\text{víz}$ | = | $4183\mathrm{\frac{J}{kg\,K}}$ | a víz fajhője |
| $c_\text{jég}$ | = | $\mathrm{\frac{J}{kg\,K}}$ | a jég fajhője |
| $c_\text{vízgőz}$ | = | $\mathrm{\frac{J}{kg\,K}}$ | a vízgőz fajhője |
Feladatok
- Mutassuk meg, hogy mechanikai- és termikus kölcsönhatásban részt vevő rendszerben állandó nyomáson végbemenő fázisátalakulásnál az átalakulási hő (
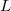 ) az entalpiaváltozással (
) az entalpiaváltozással (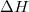 ) egyenlő!ÚtmutatásHasználjuk az entalpia definícióját és az első főtételt!
) egyenlő!ÚtmutatásHasználjuk az entalpia definícióját és az első főtételt!
-
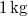 víznek normál nyomáson (
víznek normál nyomáson (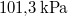 ) való elforralásához egy elektromos merülőforralón a
) való elforralásához egy elektromos merülőforralón a 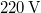 -os feszültségforrásból
-os feszültségforrásból 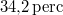 -en át
-en át 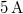 áramot kell átfolyatni. A gázállandó
áramot kell átfolyatni. A gázállandó 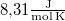 , a víz moláris tömege
, a víz moláris tömege 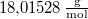 .
.
Határozzuk meg a víz- a) entalpia-,Útmutatáshasználjuk fel az előző feladat eredményét az izobár átalakulási hőre.Végeredmény
![\[\Delta H = W_\text{el} = 2{,}26\,\mathrm{MJ}\]](/images/math/4/f/d/4fdaf5770143071de6a318dd403592b3.png)
- b) entrópia- ésÚtmutatáshasználjuk az entrópia definíciójátVégeredmény
![\[\Delta S = 6{,}06\,\mathrm{\frac{kJ}{K}}\]](/images/math/7/2/7/7276d2981b6be7939e2cbb7053cfb7e9.png)
- c) belső energiaváltozását ebben a folyamatban!Útmutatásírjuk fel az entalpiaváltozás és belső energiaváltozás összefüggését, hanyagoljuk el a víz térfogatát a gőzéhez képest, és a gőzt tekintsük ideális gáznak.Végeredmény
![\[\Delta U=\Delta H-\frac{m}{M}RT=2{,}09\,\mathrm{MJ}\]](/images/math/0/8/9/089fe9b22dd39aba913ca295f3f5cd56.png)
- a) entalpia-,
- Henger alakú edényben
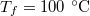 hőmérsékletű telített vízgőz van. Egy súlytalan dugattyú lassú betolásának hatására az edényben
hőmérsékletű telített vízgőz van. Egy súlytalan dugattyú lassú betolásának hatására az edényben 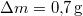 víz lecsapódik. A víz moláris tömege
víz lecsapódik. A víz moláris tömege 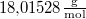 A folyamat során a nyomás a
A folyamat során a nyomás a 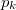 külső légnyomással egyenlő.
külső légnyomással egyenlő.
Mennyi munkát végeztünk ezalatt az ideális gáznak tekinthető vízgőzön?Végeredmény![\[\Delta W=p_k\left(V_1-V_2\right)=\frac{RT_f}{M}\Delta m=120\,\mathrm{J}\]](/images/math/0/1/c/01c0c0abb9f739cbff493a96bc03ec39.png)
- Ábrázoljuk (kvalitatív módon) egy tiszta anyag kémiai potenciáljának
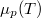 hőmérsékletfüggését állandó nyomáson, az anyag szilárd-, folyadék- és gőzállapotát átfogó hőmérséklet-intervallumban! Az olvadáspontot
hőmérsékletfüggését állandó nyomáson, az anyag szilárd-, folyadék- és gőzállapotát átfogó hőmérséklet-intervallumban! Az olvadáspontot 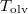 -val, a forráspontot
-val, a forráspontot 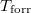 -ral jelöljük, és tegyük fel, hogy a mólentrópia egy fázison belül nem függ a hőmérséklettől!ÚtmutatásHasználjuk fel aegyenletet, a kémiai potenciál és a szabad entalpia összefüggését, továbbá két fázis egyensúlyának feltételét.
-ral jelöljük, és tegyük fel, hogy a mólentrópia egy fázison belül nem függ a hőmérséklettől!ÚtmutatásHasználjuk fel aegyenletet, a kémiai potenciál és a szabad entalpia összefüggését, továbbá két fázis egyensúlyának feltételét.![\[\left(\frac{\partial G}{\partial T}\right)_p=-S\]](/images/math/5/d/3/5d3e0ea157a966637bfd4bc7513fc8bd.png)
- Felhasználva, hogy az olvadáspont az állandó nyomáson felvett
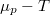 diagramban a szilárd fázisra és a folyadékra érvényes görbék metszéspontjánál van mutassuk ki, hogy a nyomás növelésekor az olvadáspont nő, ha a szilárd fázis móltérfogata kisebb, mint a folyadéké! Hogyan változik a jég olvadáspontja, a nyomás növelésekor?ÚtmutatásA nyomásváltozás a
diagramban a szilárd fázisra és a folyadékra érvényes görbék metszéspontjánál van mutassuk ki, hogy a nyomás növelésekor az olvadáspont nő, ha a szilárd fázis móltérfogata kisebb, mint a folyadéké! Hogyan változik a jég olvadáspontja, a nyomás növelésekor?ÚtmutatásA nyomásváltozás a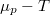 görbét eltolja, mégpedig a két fázisban általában különbözőképpen. A görbe eltolódásának mértékét adott hőmérsékleten, adott fázisban a összefüggés adja meg.
görbét eltolja, mégpedig a két fázisban általában különbözőképpen. A görbe eltolódásának mértékét adott hőmérsékleten, adott fázisban a összefüggés adja meg.![\[\left(\frac{\partial \mu }{\partial p}\right)_T= V_M\]](/images/math/2/5/a/25a4030c915d37e859e677c758ddfc3f.png)
- A szilárd-folyadék egyensúlyi görbének (olvadási görbe) közelítő meghatározására gyakran használják a
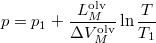 összefüggést (
összefüggést (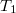 a
a 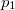 nyomáson,
nyomáson,  a
a 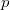 nyomáson érvényes olvadáspont, az egyenletben szereplő
nyomáson érvényes olvadáspont, az egyenletben szereplő 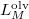 az anyag moláris átalakulási hője (vagy moláris entalpiaváltozása),
az anyag moláris átalakulási hője (vagy moláris entalpiaváltozása), 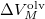 pedig a móltérfogat változása az olvadásnál).
pedig a móltérfogat változása az olvadásnál).
- a) Vezessük le ezt az egyenletet, és állapítsuk meg, hogy milyen feltételek mellett érvényes!ÚtmutatásIntegráljuk a Clausius-Clapeyron-egyenletet!
- b) Mutassuk ki, hogy a
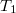 -hez képest kis
-hez képest kis  érték eseten az egyensúlyi nyomás lineárisan változik a
érték eseten az egyensúlyi nyomás lineárisan változik a  különbséggel!ÚtmutatásHasználjuk fel a kis
különbséggel!ÚtmutatásHasználjuk fel a kis -ekre érvényes
-ekre érvényes 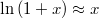 összefüggést.
összefüggést.
- a) Vezessük le ezt az egyenletet, és állapítsuk meg, hogy milyen feltételek mellett érvényes!
- Ha a nyomást
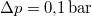 -ral megnöveljük, akkor a víz forrási hőmérséklete
-ral megnöveljük, akkor a víz forrási hőmérséklete 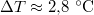 -kal növekszik. Ennek felhasználásával becsüljük meg a víz forráshőjét!ÚtmutatásA vízgőzre alkalmazzuk az ideális gáz egyenletét, és hanyagoljuk el a víz fajlagos térfogatát a gőzéhez képest!Végeredmény
-kal növekszik. Ennek felhasználásával becsüljük meg a víz forráshőjét!ÚtmutatásA vízgőzre alkalmazzuk az ideális gáz egyenletét, és hanyagoljuk el a víz fajlagos térfogatát a gőzéhez képest!Végeredmény![\[L_f\approx \frac{\Delta p}{\Delta T}\frac{RT^2}{p_kM}=2253\,\mathrm{\frac{kJ}{kg}}\]](/images/math/4/c/7/4c7c0dfc446c66a05097776d64fc920c.png)
- A szilárd argon
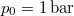 nyomáson
nyomáson 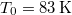 hőmérsékleten olvad meg. Olvadáshője ekkor
hőmérsékleten olvad meg. Olvadáshője ekkor 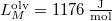 , móltérfogatának változása
, móltérfogatának változása 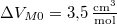 . A nyomás növekedésekor kísérleti eredmények szerint az olvadáshő nem változik, a
. A nyomás növekedésekor kísérleti eredmények szerint az olvadáshő nem változik, a 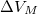 móltérfogatváltozás viszont az abszolút hőmérséklet megközelítőleg
móltérfogatváltozás viszont az abszolút hőmérséklet megközelítőleg 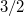 -ik hatványával arányos.
-ik hatványával arányos.
Mekkora nyomást kell alkalmaznunk ahhoz, hogy az olvadási hőmérséklet megkétszereződjék?ÚtmutatásA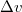 hőmérsékletfüggésének figyelembevételével integráljuk a Clausius-Clapeyron-egyenletet! Végeredmény
hőmérsékletfüggésének figyelembevételével integráljuk a Clausius-Clapeyron-egyenletet! Végeredmény![\[p=p_0+\frac{2L}{3\Delta v_0}\left(1-\left(\frac{T_0}{T}\right)^{3/2}\right)=1449\,\mathrm{bar}\]](/images/math/b/5/9/b59affbd1e174e38c0177e77ed696768.png)
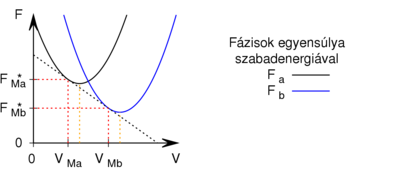
- Egy homogén anyag adott hőmérsékleten két fázisban (
 és
és 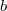 ) létezhet. Az egyes fázisok moláris szabad energiáinak térfogattól való függése (rögzített hőmérsékleten, állandó anyagmennyiség esetén) az ábrán látható.
) létezhet. Az egyes fázisok moláris szabad energiáinak térfogattól való függése (rögzített hőmérsékleten, állandó anyagmennyiség esetén) az ábrán látható.
Mutassuk ki, hogy egyensúlyi állapotban a fázisok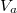 és
és 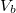 térfogatai a két görbéhez húzott közös érintő érintési pontjainak abszcisszái, a közös nyomás pedig az érintő negatív iránytangense!Útmutatásfejezzük ki a nyomást és a kémiai potenciált a szabad energiával (
térfogatai a két görbéhez húzott közös érintő érintési pontjainak abszcisszái, a közös nyomás pedig az érintő negatív iránytangense!Útmutatásfejezzük ki a nyomást és a kémiai potenciált a szabad energiával (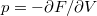 , ill.
, ill. 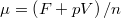 ), és használjuk ki, hogy fázisegyensúlyban a két fázis nyomása és kémiai potenciálja egyenlő!
), és használjuk ki, hogy fázisegyensúlyban a két fázis nyomása és kémiai potenciálja egyenlő!