„Termodinamika példák - Diffúzió és belső súrlódás” változatai közötti eltérés
A Fizipedia wikiből
a (→Megoldás) |
a |
||
| 6. sor: | 6. sor: | ||
| tárgynév = Kísérleti fizika 3. gyakorlat | | tárgynév = Kísérleti fizika 3. gyakorlat | ||
| gyaksorszám = 1 | | gyaksorszám = 1 | ||
| − | |||
| témakör = Termodinamika - Kinetikus gázelmélet, transzportfolyamatok | | témakör = Termodinamika - Kinetikus gázelmélet, transzportfolyamatok | ||
| − | | | + | | rövid = Kinetikus gázelmélet, transzport |
| − | + | ||
| − | + | ||
| − | + | ||
}} | }} | ||
== Feladat == | == Feladat == | ||
A lap 2013. április 23., 20:23-kori változata
| [rejt] Navigáció Pt·1·2·3 |
|---|
| Kísérleti fizika 3. gyakorlat |
| Gyakorlatok listája: |
| Kinetikus gázelmélet, transzport |
| Feladatok listája: |
| © 2012-2013 BME-TTK, TÁMOP4.1.2.A/1-11/0064 |
Feladat
- Hogyan változik az ideális gáz
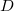 diffúziós állandója és
diffúziós állandója és 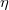 belső súrlódási együtthatója, ha a gáz térfogata
belső súrlódási együtthatója, ha a gáz térfogata 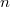 -szersére nő
-szersére nő
- a) állandó hőmérsékleten,
- b) állandó nyomáson?
Megoldás
A diffúzióállandó (vö.  az részecske-áramsűrűség)
az részecske-áramsűrűség)
![\[ D = \frac13\bar l\bar v \]](/images/math/2/4/2/2425e15b27ede2deefcee0a14beacccf.png)
képlettel az 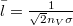 átlagos szabad úthosszból és a
átlagos szabad úthosszból és a 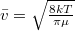 átlagos molekulasebességből határozható meg.
átlagos molekulasebességből határozható meg.
A viszkozitás (vö. 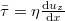 a nyíróerő)
a nyíróerő)
![\[ \eta = -\frac13 \bar l \bar v n_V \mu \]](/images/math/0/3/4/034861e8b9864cd1eab205f9615b9e6c.png)
alakba írható, ahol 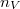 a molekulaszám-sűrűség,
a molekulaszám-sűrűség, 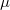 pedig a molekulák tömege.
pedig a molekulák tömege.
Behelyettesítve
![\[ D(T,V) = \frac13 \frac{V}{\sqrt 2 N \sigma} \sqrt{\frac{8kT}{\pi\mu}} = \frac2{\sigma} \frac{V}{N} \sqrt{\frac{kT}{\pi\mu}} \]](/images/math/0/4/3/043448dbf5a396580b8f5c9657ebb911.png)
és
![\[ \eta(T,V)= -\frac13 \frac1{\sqrt 2 \sigma} \sqrt{\frac{8kT}{\pi\mu}} \mu = - \frac2{ 3\sigma} \sqrt{\frac{kT\mu}{\pi}}. \]](/images/math/1/a/5/1a5b0e1902a72d4655461833251625d7.png)
- (a) állandó hőmérsékleten
![\[ D \propto V, \]](/images/math/3/9/3/3938cf46aeaae956b20825a10d3ee77d.png) A diffúziós együttható
A diffúziós együttható![\[ \eta \propto 1. \]](/images/math/f/6/f/f6fde6bcc6e5cb3e49087c675c836ccd.png)
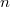 -szeresére nől, a viszkozitás állandó marad.
-szeresére nől, a viszkozitás állandó marad.
- (b) állandó nyomáson az egyetemes gáztörvényből kifejezzük a hőmérséklet nyomásfüggését: azaz
![\[ pV = NkT \qquad \Rightarrow \qquad \sqrt{T} \propto \sqrt{pV}, \]](/images/math/c/1/b/c1b8ebd7d7bdbd0c60487945c392f3d0.png)
![\[ D \propto V^{3/2},\]](/images/math/a/f/1/af1087ad9e85b4369854b981cbe34f60.png) A diffúziós együttható
A diffúziós együttható![\[ \eta \propto \sqrt V. \]](/images/math/5/4/d/54d92759533429a759900d651fa61d18.png)
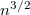 -szeresére, a viszkozitás
-szeresére, a viszkozitás 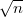 -szeresére nől.
-szeresére nől.