„Termodinamika példák - Gázcsere két gázzal” változatai közötti eltérés
a |
a (Szöveg koherenssé tétele) |
||
| 11. sor: | 11. sor: | ||
</noinclude><wlatex># Két azonos térfogatú tartály kacsolódik egymáshoz, a szabad úthosszhoz képest kisméretű nyíláson keresztül. Az egyikben $p_K$ nyomású hidrogéngáz, a másikban kétszer akkora nyomású oxigéngáz van. A gázok $T$ hőmérséklete azonos és időben állandó. A kinetikus gázelmélet segítségével mutassuk ki, hogy a két tartályban azonos $p=3p_\text{kezd}/2$ egyensúlyi nyomás alakul ki!</wlatex><includeonly><wlatex>{{Útmutatás|content=Használjuk ki, hogy a két gáz nem hat kölcsön, alkalmazzuk a parciális nyomások tételét.}}</wlatex></includeonly><noinclude> | </noinclude><wlatex># Két azonos térfogatú tartály kacsolódik egymáshoz, a szabad úthosszhoz képest kisméretű nyíláson keresztül. Az egyikben $p_K$ nyomású hidrogéngáz, a másikban kétszer akkora nyomású oxigéngáz van. A gázok $T$ hőmérséklete azonos és időben állandó. A kinetikus gázelmélet segítségével mutassuk ki, hogy a két tartályban azonos $p=3p_\text{kezd}/2$ egyensúlyi nyomás alakul ki!</wlatex><includeonly><wlatex>{{Útmutatás|content=Használjuk ki, hogy a két gáz nem hat kölcsön, alkalmazzuk a parciális nyomások tételét.}}</wlatex></includeonly><noinclude> | ||
== Megoldás == | == Megoldás == | ||
| − | <wlatex> | + | <wlatex>A gázcsere kis lyukon keresztül valósul meg a tartályok között, feltehetjük, hogy a gáz egy-egy tartályon belül végig egyensúlyi állapotban marad. Ha a lyuk mérete sokkal kisebb az átlagos szabad úthossznál, akkor a rajta keresztül időegység alatt távozó molekulák száma megegyezik azzal, amit a gáz kinetikus elméletében a nyomás tárgyalásakor a tartály falának ugyanakkora felületét időegység alatt érő molekulák számára kapunk ($\frac14 n_V A \langle v \rangle$). Ideális gázok molekulái sem saját fajtájukkal, sem a másik gázzal nem hatnak kölcsön, ezért külön differenciálegyenleteket írhatunk fel az egyes gázokra: |
$$ \frac{\mathrm{d}N^{(1)}_H}{\mathrm{d}t} = | $$ \frac{\mathrm{d}N^{(1)}_H}{\mathrm{d}t} = | ||
- \frac14 n_{VH}^{(1)}\langle v_H \rangle A | - \frac14 n_{VH}^{(1)}\langle v_H \rangle A | ||
| 21. sor: | 21. sor: | ||
= \frac14 \langle v_O \rangle A \left(n_{VO}^{(2)}-n_{VO}^{(1)}\right),$$ | = \frac14 \langle v_O \rangle A \left(n_{VO}^{(2)}-n_{VO}^{(1)}\right),$$ | ||
a molekulák átlagos sebessége $\langle v \rangle = \sqrt{\frac{8kT}{\pi \mu }}$ fordítottan arányos a $\mu$ molekulatömeggel (a két tartály | a molekulák átlagos sebessége $\langle v \rangle = \sqrt{\frac{8kT}{\pi \mu }}$ fordítottan arányos a $\mu$ molekulatömeggel (a két tartály | ||
| − | hőmérséklete | + | hőmérséklete azonos): $\mu_{H_2}=2\,\mathrm{\frac{g}{mol}}$, $\mu_{O_2}=32\,\mathrm{\frac{g}{mol}}$. Az anyagmegmaradás következtében a 2. tartály tartalmát nem kell külön számon tartanunk. |
| − | Legyen kezdetben az 1. tartályban a hidrogén és a | + | Legyen kezdetben az 1. tartályban a hidrogén és a 2.-ban az oxigén: |
$$ n_{VH\text{kezd}}^{(1)} = n_{VH\text{kezd}}, \qquad n_{VH\text{kezd}}^{(2)}=0, $$ | $$ n_{VH\text{kezd}}^{(1)} = n_{VH\text{kezd}}, \qquad n_{VH\text{kezd}}^{(2)}=0, $$ | ||
$$ n_{VO\text{kezd}}^{(2)} = n_{VO\text{kezd}}, \qquad n_{VO\text{kezd}}^{(1)}=0. $$ | $$ n_{VO\text{kezd}}^{(2)} = n_{VO\text{kezd}}, \qquad n_{VO\text{kezd}}^{(1)}=0. $$ | ||
| 29. sor: | 29. sor: | ||
Egyensúlyban $\frac{\mathrm{d}N^{(1)}_H}{\mathrm{d}t}=0$, azaz $n_{VH\text{vég}}^{(1)}=n_{VH\text{vég}}^{(2)}=n_{VH\text{vég}}$. | Egyensúlyban $\frac{\mathrm{d}N^{(1)}_H}{\mathrm{d}t}=0$, azaz $n_{VH\text{vég}}^{(1)}=n_{VH\text{vég}}^{(2)}=n_{VH\text{vég}}$. | ||
| − | Az anyagmegmaradás értelmében $N_H^{(2)}=N_H-N_H^{(1)}$ | + | Az anyagmegmaradás értelmében $N_H^{(2)}=N_H-N_H^{(1)}$: |
$$ V^{(1)} n_{VH} = V^{(1)} n_{VH}^{(1)} + V^{(2)} n_{VH}^{(2)} = n_{VH\text{vég}} \left( V^{(1)} + V^{(2)} \right), $$ | $$ V^{(1)} n_{VH} = V^{(1)} n_{VH}^{(1)} + V^{(2)} n_{VH}^{(2)} = n_{VH\text{vég}} \left( V^{(1)} + V^{(2)} \right), $$ | ||
| − | az | + | az a kezdeti feltételeket behelyettesítve a hidrogénre és analóg módon az oxigénre |
| − | $$ n_{VH\text{vég}} = \frac{V^{(1)}}{V^{(1)} + V^{(2)}} n_{VH\text{kezd}} $$ | + | $$ n_{VH\text{vég}} = \frac{V^{(1)}}{V^{(1)} + V^{(2)}} n_{VH\text{kezd}}, $$ |
| − | + | $$ n_{VO\text{vég}} = \frac{V^{(2)}}{V^{(1)} + V^{(2)}} n_{VO\text{kezd}}. $$ | |
| − | $$ n_{VO\text{vég}} = \frac{V^{(2)}}{V^{(1)} + V^{(2)}} n_{VO\text{kezd}} $$ | + | |
| − | + | ||
A kezdeti $p_\text{kezd} = n_{VH\text{kezd}}kT$ és $2p_\text{kezd} = n_{VO}kT$ nyomásokból $2n_{VH\text{kezd}}=n_{VO}$ összefüggést nyerjük. | A kezdeti $p_\text{kezd} = n_{VH\text{kezd}}kT$ és $2p_\text{kezd} = n_{VO}kT$ nyomásokból $2n_{VH\text{kezd}}=n_{VO}$ összefüggést nyerjük. | ||
A kialakuló | A kialakuló | ||
| − | $$p_{O\text{vég}} = n_{VO\text{vég}}kT = \frac{V^{(2)}}{V^{(1)}+V^{(2)}} 2p_\text{kezd}$$ | + | $$ p_{O\text{vég}} = n_{VO\text{vég}}kT = \frac{V^{(2)}}{V^{(1)}+V^{(2)}} 2p_\text{kezd}, $$ |
| − | + | $$ p_{H\text{vég}} = n_{VH\text{vég}}kT = \frac{V^{(1)}}{V^{(1)}+V^{(2)}} p_\text{kezd} $$ | |
| − | $$p_{H\text{vég}} = n_{VH\text{vég}}kT = \frac{V^{(1)}}{V^{(1)}+V^{(2)}} p_\text{kezd}$$ | + | nyomásokból pedig a parciális nyomások tétele (Dalton-törvény) szerint |
| − | nyomásokból pedig a parciális nyomások tétele szerint | + | |
$$ p_\text{vég} = p_{H\text{vég}} + p_{O\text{vég}} | $$ p_\text{vég} = p_{H\text{vég}} + p_{O\text{vég}} | ||
= \left(\frac{2V^{(2)}}{V^{(1)}+V^{(2)}} + \frac{V^{(1)}}{V^{(1)}+V^{(2)}}\right) p_\text{kezd}$$ | = \left(\frac{2V^{(2)}}{V^{(1)}+V^{(2)}} + \frac{V^{(1)}}{V^{(1)}+V^{(2)}}\right) p_\text{kezd}$$ | ||
adódik. | adódik. | ||
| − | Speciálisan a | + | Speciálisan a feladatban $V^{(1)}=V^{(2)}=V$, (továbbá $N_{H\text{kezd}}^{(1)}=N_{O\text{kezd}}^{(2)}/2=N/3$), így a kialakuló egyensúlyi nyomás $p=3p_\text{kezd}/2$. |
A részecskeszámokra vonatkozó differenciálegyenletek megoldása az [[Termodinamika példák - Gázcsere tartályok közt#Kiegészítés|előző feladatéval]] analóg. | A részecskeszámokra vonatkozó differenciálegyenletek megoldása az [[Termodinamika példák - Gázcsere tartályok közt#Kiegészítés|előző feladatéval]] analóg. | ||
A lap 2013. április 27., 10:55-kori változata
| [rejt] Navigáció Pt·1·2·3 |
|---|
| Kísérleti fizika 3. gyakorlat |
| Gyakorlatok listája: |
| Kinetikus gázelmélet, transzport |
| Feladatok listája: |
| © 2012-2013 BME-TTK, TÁMOP4.1.2.A/1-11/0064 |
Feladat
- Két azonos térfogatú tartály kacsolódik egymáshoz, a szabad úthosszhoz képest kisméretű nyíláson keresztül. Az egyikben
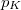 nyomású hidrogéngáz, a másikban kétszer akkora nyomású oxigéngáz van. A gázok
nyomású hidrogéngáz, a másikban kétszer akkora nyomású oxigéngáz van. A gázok  hőmérséklete azonos és időben állandó. A kinetikus gázelmélet segítségével mutassuk ki, hogy a két tartályban azonos
hőmérséklete azonos és időben állandó. A kinetikus gázelmélet segítségével mutassuk ki, hogy a két tartályban azonos 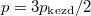 egyensúlyi nyomás alakul ki!
egyensúlyi nyomás alakul ki!
Megoldás
A gázcsere kis lyukon keresztül valósul meg a tartályok között, feltehetjük, hogy a gáz egy-egy tartályon belül végig egyensúlyi állapotban marad. Ha a lyuk mérete sokkal kisebb az átlagos szabad úthossznál, akkor a rajta keresztül időegység alatt távozó molekulák száma megegyezik azzal, amit a gáz kinetikus elméletében a nyomás tárgyalásakor a tartály falának ugyanakkora felületét időegység alatt érő molekulák számára kapunk (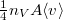 ). Ideális gázok molekulái sem saját fajtájukkal, sem a másik gázzal nem hatnak kölcsön, ezért külön differenciálegyenleteket írhatunk fel az egyes gázokra:
). Ideális gázok molekulái sem saját fajtájukkal, sem a másik gázzal nem hatnak kölcsön, ezért külön differenciálegyenleteket írhatunk fel az egyes gázokra:
![\[ \frac{\mathrm{d}N^{(1)}_H}{\mathrm{d}t} = - \frac14 n_{VH}^{(1)}\langle v_H \rangle A + \frac14 n_{VH}^{(2)}\langle v_H \rangle A = \frac14 \langle v_H \rangle A \left(n_{VH}^{(2)}-n_{VH}^{(1)}\right),\]](/images/math/4/f/e/4fe23ec8292a3856b2a4b960f7cc8eab.png)
![\[ \frac{\mathrm{d}N^{(1)}_O}{\mathrm{d}t} = - \frac14 n_{VO}^{(1)}\langle v_O \rangle A + \frac14 n_{VO}^{(2)}\langle v_O \rangle A = \frac14 \langle v_O \rangle A \left(n_{VO}^{(2)}-n_{VO}^{(1)}\right),\]](/images/math/1/d/8/1d865fea490a6c0d5037c1a7458382ff.png)
a molekulák átlagos sebessége 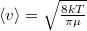 fordítottan arányos a
fordítottan arányos a 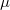 molekulatömeggel (a két tartály
hőmérséklete azonos):
molekulatömeggel (a két tartály
hőmérséklete azonos): 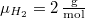 ,
, 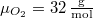 . Az anyagmegmaradás következtében a 2. tartály tartalmát nem kell külön számon tartanunk.
. Az anyagmegmaradás következtében a 2. tartály tartalmát nem kell külön számon tartanunk.
Legyen kezdetben az 1. tartályban a hidrogén és a 2.-ban az oxigén:
![\[ n_{VH\text{kezd}}^{(1)} = n_{VH\text{kezd}}, \qquad n_{VH\text{kezd}}^{(2)}=0, \]](/images/math/2/c/3/2c36e36f23703b17caaa11226c07dbb6.png)
![\[ n_{VO\text{kezd}}^{(2)} = n_{VO\text{kezd}}, \qquad n_{VO\text{kezd}}^{(1)}=0. \]](/images/math/7/2/0/72055b6b0f0ef23490ff662122848289.png)
Egyensúlyban 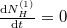 , azaz
, azaz 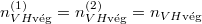 .
.
Az anyagmegmaradás értelmében 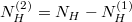 :
:
![\[ V^{(1)} n_{VH} = V^{(1)} n_{VH}^{(1)} + V^{(2)} n_{VH}^{(2)} = n_{VH\text{vég}} \left( V^{(1)} + V^{(2)} \right), \]](/images/math/a/c/f/acf714739e957d1481ab258a52cfbcf2.png)
az a kezdeti feltételeket behelyettesítve a hidrogénre és analóg módon az oxigénre
![\[ n_{VH\text{vég}} = \frac{V^{(1)}}{V^{(1)} + V^{(2)}} n_{VH\text{kezd}}, \]](/images/math/8/2/9/8295412765028883d11dbfce57ac2913.png)
![\[ n_{VO\text{vég}} = \frac{V^{(2)}}{V^{(1)} + V^{(2)}} n_{VO\text{kezd}}. \]](/images/math/b/5/d/b5d90c1591846d8f362f89bb8d22e0b6.png)
A kezdeti 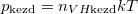 és
és 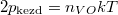 nyomásokból
nyomásokból 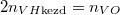 összefüggést nyerjük.
A kialakuló
összefüggést nyerjük.
A kialakuló
![\[ p_{O\text{vég}} = n_{VO\text{vég}}kT = \frac{V^{(2)}}{V^{(1)}+V^{(2)}} 2p_\text{kezd}, \]](/images/math/d/b/6/db6bc129beb3e471105f36c6465e6208.png)
![\[ p_{H\text{vég}} = n_{VH\text{vég}}kT = \frac{V^{(1)}}{V^{(1)}+V^{(2)}} p_\text{kezd} \]](/images/math/5/b/e/5be802f24005b51828b34ae3d2db9209.png)
nyomásokból pedig a parciális nyomások tétele (Dalton-törvény) szerint
![\[ p_\text{vég} = p_{H\text{vég}} + p_{O\text{vég}} = \left(\frac{2V^{(2)}}{V^{(1)}+V^{(2)}} + \frac{V^{(1)}}{V^{(1)}+V^{(2)}}\right) p_\text{kezd}\]](/images/math/9/b/5/9b5a6b90d0b83db935d03b788197d48b.png)
adódik.
Speciálisan a feladatban 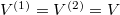 , (továbbá
, (továbbá 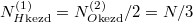 ), így a kialakuló egyensúlyi nyomás
), így a kialakuló egyensúlyi nyomás 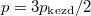 .
.
A részecskeszámokra vonatkozó differenciálegyenletek megoldása az előző feladatéval analóg.