„Termodinamika példák - Állapotváltozások diagramjai” változatai közötti eltérés
A Fizipedia wikiből
(Új oldal, tartalma: „<noinclude> Kategória:Kísérleti fizika 3. gyakorlat Kategória:Szerkesztő:Stippinger Kategória:Termodinamika {{Kísérleti fizika gyakorlat | tárgynév …”) |
a (Szöveg koherenssé tétele) |
||
| (egy szerkesztő 6 közbeeső változata nincs mutatva) | |||
| 16. sor: | 16. sor: | ||
#: állapotváltozásáról $p-V$, $T-V$ és $T-p$ koordináta-rendszerekben úgy, hogy a kiindulási állapot minden esetben ugyanaz legyen!</wlatex><noinclude> | #: állapotváltozásáról $p-V$, $T-V$ és $T-p$ koordináta-rendszerekben úgy, hogy a kiindulási állapot minden esetben ugyanaz legyen!</wlatex><noinclude> | ||
== Megoldás == | == Megoldás == | ||
| − | <wlatex> | + | <wlatex>A közös kiindulási állapotot jellemezze $p_0$ nyomás, $V_0$ térfogat és $T_0$ hőmérséklet. A görbék megszerkesztéséhez a $pV=n R\cdot T$ állapotegyenletből és az adiabatita egyenletéből indulunk ki. Az adiabatát |
| + | * $p-V$ diagramban $p V^\gamma=\mathrm{const.}$ írja le, ahol $\gamma = \frac{f+2}{f}> 1$; ezt $\frac{pV}{T}=\mathrm{conts.}$ állapotegyenlettel osztva | ||
| + | * $T-V$ diagramban $T V^{\gamma-1}=\mathrm{const.}$; amit $p^{\frac{\gamma-1}{\gamma}} V^{\frac{\gamma-1}{\gamma}\gamma}=\mathrm{const.}$ adiabataegyenlettel osztva a | ||
| + | * $T-p$ diagrambeli $T p^{\frac{1-\gamma}{\gamma}}=\mathrm{const.}$ összefüggést nyerjük. | ||
| + | Fontos megfigyelni a görbék (elméletbeni) meredekségét az origóban. | ||
| + | |||
| + | [[Fájl:Állapotváltozások diagramjai.svg|400px]] | ||
</wlatex> | </wlatex> | ||
</noinclude> | </noinclude> | ||
A lap jelenlegi, 2013. április 28., 16:33-kori változata
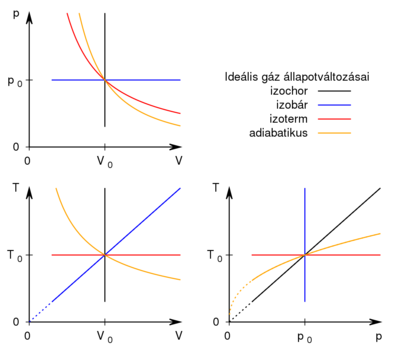
Feladat
- Készítsen vázlatos ábrát ideális gáz
- a) izochor,
- b) izobár,
- c) izoterm és
- d) adiabatikus
- állapotváltozásáról
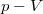 ,
, 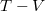 és
és 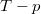 koordináta-rendszerekben úgy, hogy a kiindulási állapot minden esetben ugyanaz legyen!
koordináta-rendszerekben úgy, hogy a kiindulási állapot minden esetben ugyanaz legyen!
Megoldás
A közös kiindulási állapotot jellemezze 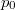 nyomás,
nyomás, 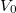 térfogat és
térfogat és 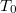 hőmérséklet. A görbék megszerkesztéséhez a
hőmérséklet. A görbék megszerkesztéséhez a 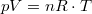 állapotegyenletből és az adiabatita egyenletéből indulunk ki. Az adiabatát
állapotegyenletből és az adiabatita egyenletéből indulunk ki. Az adiabatát
-
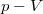 diagramban
diagramban 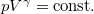 írja le, ahol
írja le, ahol 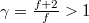 ; ezt
; ezt 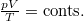 állapotegyenlettel osztva
állapotegyenlettel osztva
-
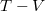 diagramban
diagramban 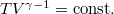 ; amit
; amit 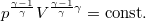 adiabataegyenlettel osztva a
adiabataegyenlettel osztva a
-
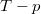 diagrambeli
diagrambeli 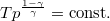 összefüggést nyerjük.
összefüggést nyerjük.
Fontos megfigyelni a görbék (elméletbeni) meredekségét az origóban.