„Termodinamika példák - Energia-összefüggések fajhőviszonnyal” változatai közötti eltérés
A Fizipedia wikiből
(Új oldal, tartalma: „<noinclude> Kategória:Kísérleti fizika 3. gyakorlat Kategória:Szerkesztő:Stippinger Kategória:Termodinamika {{Kísérleti fizika gyakorlat | tárgynév …”) |
a (Szöveg koherenssé tétele) |
||
| (egy szerkesztő 2 közbeeső változata nincs mutatva) | |||
| 11. sor: | 11. sor: | ||
</noinclude><wlatex># Állapítsuk meg, milyen összefüggés van egy ideális gáz által állandó nyomáson végzett $\Delta W$ munka, a gázzal közölt $\Delta Q$ hőmennyiség és a $\Delta U$ belső energia-változás között, ha a $\gamma$ fajhőviszony ismert!</wlatex><includeonly><wlatex>{{Végeredmény|content=$$\Delta Q = \frac{\gamma}{\gamma-1}\Delta W = \gamma \Delta U$$}}</wlatex></includeonly><noinclude> | </noinclude><wlatex># Állapítsuk meg, milyen összefüggés van egy ideális gáz által állandó nyomáson végzett $\Delta W$ munka, a gázzal közölt $\Delta Q$ hőmennyiség és a $\Delta U$ belső energia-változás között, ha a $\gamma$ fajhőviszony ismert!</wlatex><includeonly><wlatex>{{Végeredmény|content=$$\Delta Q = \frac{\gamma}{\gamma-1}\Delta W = \gamma \Delta U$$}}</wlatex></includeonly><noinclude> | ||
== Megoldás == | == Megoldás == | ||
| − | <wlatex> | + | <wlatex>Állandó nyomáson a gáz által végzett munka szorzatalakú, és az első főtétel segítségével kifejezhető a hőmérsékletváltozás függvényeként: |
| + | $$ \Delta W = p\Delta V = nR\Delta T. $$ | ||
| + | |||
| + | Az ekvipartíció tétele értelmében az ideális gáz belső energiája kifejezhető a hőmérsékletével, így a belső energia megváltozása is: | ||
| + | $$ \Delta U = \frac{f}{2}nR\Delta T = \frac f 2\Delta W. $$ | ||
| + | |||
| + | A $\gamma$ fajhőviszony és a gáz $f$ szabadsági fokai közti összefüggés: | ||
| + | $$ \gamma = \frac{C_p}{C_V} = \frac{f+2}{f},$$ | ||
| + | $$ \frac{f}{2} = \frac{1}{\gamma-1},$$ | ||
| + | amivel | ||
| + | $$\Delta U = \frac{\Delta W}{\gamma-1}$$ | ||
| + | |||
| + | Az állandó nyomáson a gázzal közölt hő definíció szerint az állandó nyomáson mért fajhővel írható fel: | ||
| + | $$ \Delta Q = C_pn\Delta T = \frac{C_p}{R} \Delta W. $$ | ||
| + | |||
| + | Az egyetemes gázállandó és a fajhők közötti kapcsolat például az állandó nyomáson mért fajhő definíciójából teremthető meg: | ||
| + | $$ C_V = \frac{1}{n}\frac{\mathrm{d}U}{\mathrm{d}T} = \frac{f}{2}R. $$ | ||
| + | |||
| + | A fajhőviszony segítségével | ||
| + | $$ C_p = \left(\frac f 2+1\right)R = C_V+R = \frac{\gamma}{\gamma-1}R, $$ | ||
| + | amiből | ||
| + | $$ \Delta Q = \frac{\gamma}{\gamma-1}\Delta W = \gamma\Delta U.$$ | ||
| + | |||
| + | == Megjegyzés == | ||
| + | Egy másik lehetőség az egyetemes gázállandó és a fajhők közötti kapcsolat megteremtésére, hogy állandó térfogaton | ||
| + | $$ \Delta U = \delta Q = n C_V \Delta T, $$ | ||
| + | amit $\Delta U = \frac{f}{2}nR\Delta T$-val összevetve szintén | ||
| + | $$ C_V = \frac{f}{2}R. $$ | ||
</wlatex> | </wlatex> | ||
</noinclude> | </noinclude> | ||
A lap jelenlegi, 2013. április 28., 16:48-kori változata
Feladat
- Állapítsuk meg, milyen összefüggés van egy ideális gáz által állandó nyomáson végzett
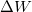 munka, a gázzal közölt
munka, a gázzal közölt 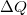 hőmennyiség és a
hőmennyiség és a 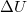 belső energia-változás között, ha a
belső energia-változás között, ha a 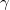 fajhőviszony ismert!
fajhőviszony ismert!
Megoldás
Állandó nyomáson a gáz által végzett munka szorzatalakú, és az első főtétel segítségével kifejezhető a hőmérsékletváltozás függvényeként:
![\[ \Delta W = p\Delta V = nR\Delta T. \]](/images/math/1/9/1/191a2875256b7f8ad0a9949d15294212.png)
Az ekvipartíció tétele értelmében az ideális gáz belső energiája kifejezhető a hőmérsékletével, így a belső energia megváltozása is:
![\[ \Delta U = \frac{f}{2}nR\Delta T = \frac f 2\Delta W. \]](/images/math/9/9/d/99d2cc6994daceee672c34ce18a4d454.png)
A 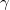 fajhőviszony és a gáz
fajhőviszony és a gáz 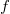 szabadsági fokai közti összefüggés:
szabadsági fokai közti összefüggés:
![\[ \gamma = \frac{C_p}{C_V} = \frac{f+2}{f},\]](/images/math/8/2/2/822832f3865873a7eddc0a2b477e611d.png)
![\[ \frac{f}{2} = \frac{1}{\gamma-1},\]](/images/math/d/3/e/d3e640df4a06a7cf5f3f467b64aed59b.png)
amivel
![\[\Delta U = \frac{\Delta W}{\gamma-1}\]](/images/math/e/f/3/ef388cea80a3b527aa19f573a0186d20.png)
Az állandó nyomáson a gázzal közölt hő definíció szerint az állandó nyomáson mért fajhővel írható fel:
![\[ \Delta Q = C_pn\Delta T = \frac{C_p}{R} \Delta W. \]](/images/math/8/1/f/81f5c39717535d2010929c413dce3ba5.png)
Az egyetemes gázállandó és a fajhők közötti kapcsolat például az állandó nyomáson mért fajhő definíciójából teremthető meg:
![\[ C_V = \frac{1}{n}\frac{\mathrm{d}U}{\mathrm{d}T} = \frac{f}{2}R. \]](/images/math/6/8/3/683d597a5468b347cf48074ed1001309.png)
A fajhőviszony segítségével
![\[ C_p = \left(\frac f 2+1\right)R = C_V+R = \frac{\gamma}{\gamma-1}R, \]](/images/math/7/7/3/773f25f617e7f2d54af0570d8dc4cb9e.png)
amiből
![\[ \Delta Q = \frac{\gamma}{\gamma-1}\Delta W = \gamma\Delta U.\]](/images/math/2/8/6/2865d7fb0d87f46fe411fa468f76cacf.png)
Megjegyzés
Egy másik lehetőség az egyetemes gázállandó és a fajhők közötti kapcsolat megteremtésére, hogy állandó térfogaton
![\[ \Delta U = \delta Q = n C_V \Delta T, \]](/images/math/3/c/3/3c37e70a9704d7764e0c14b8dcd12c7b.png)
amit 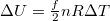 -val összevetve szintén
-val összevetve szintén
![\[ C_V = \frac{f}{2}R. \]](/images/math/1/7/f/17f647005bd33283a7f2e8d5c1b7dfba.png)