„Termodinamika példák - Térfogatváltozás fajhőviszonnyal” változatai közötti eltérés
A Fizipedia wikiből
(→Megoldás) |
a |
||
| (egy szerkesztő 2 közbeeső változata nincs mutatva) | |||
| 12. sor: | 12. sor: | ||
== Megoldás == | == Megoldás == | ||
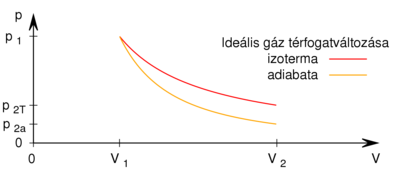
<wlatex>Azonos kezdeti feltételekből izoterm állapotváltozás során | <wlatex>Azonos kezdeti feltételekből izoterm állapotváltozás során | ||
| − | $$ p_1 V_1 = p_{2\text{T}} V_2 $$ | + | $$ p_1 V_1 = p_{2\text{T}} V_2, $$ |
míg adiabatikusan | míg adiabatikusan | ||
$$ p_1 V_1^\gamma = p_{2\text{ad}} V_2^\gamma. $$ | $$ p_1 V_1^\gamma = p_{2\text{ad}} V_2^\gamma. $$ | ||
| 18. sor: | 18. sor: | ||
A két egyenletet egymással elosztva | A két egyenletet egymással elosztva | ||
$$ V_1^{\gamma-1} = \frac{p_{2\text{ad}}}{p_{2\text{T}}} V_2^{\gamma-1}, $$ | $$ V_1^{\gamma-1} = \frac{p_{2\text{ad}}}{p_{2\text{T}}} V_2^{\gamma-1}, $$ | ||
| − | ahol a feladat szerint $\frac{p_{2\text{T}}{p_{2\text{ad}}=2$ (táguláskor az 1:2 arány csak ebben az irányban teljesülhet, mert az adiabata meredekebb, mint az izoterma), innen | + | ahol a feladat szerint $\frac{p_{2\text{T}}}{p_{2\text{ad}}}=2$ (táguláskor az 1:2 arány csak ebben az irányban teljesülhet, mert az adiabata meredekebb, mint az izoterma), innen |
| − | $$ V_2 = V_1 \cdot 2^{\frac{1}{\gamma-1}}$$ | + | $$ V_2 = V_1 \cdot 2^{\textstyle \frac{1}{\gamma-1}}. $$ |
[[Fájl:Ideális gáz térfogatváltozása.svg|400px]] | [[Fájl:Ideális gáz térfogatváltozása.svg|400px]] | ||
</wlatex> | </wlatex> | ||
</noinclude> | </noinclude> | ||
A lap jelenlegi, 2013. április 28., 18:08-kori változata
Feladat
- Egy kezdetben
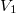 térfogatú,
térfogatú, 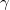 fajhőviszonyú ideális gáz térfogatát
fajhőviszonyú ideális gáz térfogatát 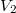 -re növeljük. A folyamatot egyszer adiabatikusan, másodszor pedig izotermikusan hajtjuk végre. Az első és második végállapotban a nyomások aránya
-re növeljük. A folyamatot egyszer adiabatikusan, másodszor pedig izotermikusan hajtjuk végre. Az első és második végállapotban a nyomások aránya 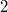 . Mekkora a
. Mekkora a 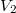 térfogat?
térfogat?
Megoldás
Azonos kezdeti feltételekből izoterm állapotváltozás során
![\[ p_1 V_1 = p_{2\text{T}} V_2, \]](/images/math/e/a/6/ea6e023a222ead0900315bd9c7dc3e5c.png)
míg adiabatikusan
![\[ p_1 V_1^\gamma = p_{2\text{ad}} V_2^\gamma. \]](/images/math/4/5/8/4586ba149c481541b21d8195f02bd026.png)
A két egyenletet egymással elosztva
![\[ V_1^{\gamma-1} = \frac{p_{2\text{ad}}}{p_{2\text{T}}} V_2^{\gamma-1}, \]](/images/math/4/c/b/4cb48b4ac50bf60bf5820a17352434cf.png)
ahol a feladat szerint 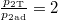 (táguláskor az 1:2 arány csak ebben az irányban teljesülhet, mert az adiabata meredekebb, mint az izoterma), innen
(táguláskor az 1:2 arány csak ebben az irányban teljesülhet, mert az adiabata meredekebb, mint az izoterma), innen
![\[ V_2 = V_1 \cdot 2^{\textstyle \frac{1}{\gamma-1}}. \]](/images/math/a/5/4/a542bb33290c89b5c923c4ebdac8bc74.png)