„Termodinamika példák - Ideális gáz állapotváltozása egyenlettel” változatai közötti eltérés
A Fizipedia wikiből
(Új oldal, tartalma: „<noinclude> Kategória:Kísérleti fizika 3. gyakorlat Kategória:Szerkesztő:Stippinger Kategória:Termodinamika [[Kategória:Termodinamika - Kinetikus gázel…”) |
(→Megoldás) |
||
| 15. sor: | 15. sor: | ||
$$\delta Q = \left(\frac{\partial U}{\partial T}\right)_V\mathrm{d}T+ | $$\delta Q = \left(\frac{\partial U}{\partial T}\right)_V\mathrm{d}T+ | ||
\left(\frac{\partial U}{\partial V}\right)_T\mathrm{d}V+ p\,\mathrm{d}V.$$ | \left(\frac{\partial U}{\partial V}\right)_T\mathrm{d}V+ p\,\mathrm{d}V.$$ | ||
| + | Az utolsó két tag sorrendjét felcserélve ''általánosan'' levezethető, hogy | ||
| + | $$C n \mathrm{d}T = C_V n \mathrm{d}T+ | ||
| + | \left[p+\frac{\partial U}{\partial V}\right]_T\mathrm{d}V.$$ | ||
| + | Az ideális gázra speciálisan a belső energia térfogat szerinti parciális deriváltja nulla. A térfogat infinitezimális megváltozását a folyamatot jellemző úton kifejezhetjük a hőmérséklettel: | ||
| + | $$C n \mathrm{d}T = C_V n \mathrm{d}T+ | ||
| + | p\left(\frac{\mathrm{d} V}{\mathrm{d} T}\right)_{\text{állapotváltozás}}\mathrm{d}T.$$ | ||
| + | Az ideális gáz $pV=nRT$ állapotegyenletéből és a folyamatot jellemző $p=\frac{k^2}{V^2}$ egyenletből a térfogat és a folyamatot jellemző deriváltja számítható: | ||
| + | $$V=\frac{k^2}{nRT}\qquad\text{és}\qquad\frac{\mathrm{d}V}{\mathrm{d}T}=-\frac{k^2}{nRT^2}$$ | ||
| + | Ezt visszaírva a folyamatot jellemző $C$ fajhő kifejezésébe azt kapjuk, hogy | ||
</wlatex> | </wlatex> | ||
</noinclude> | </noinclude> | ||
A lap 2012. október 9., 20:38-kori változata
| [rejt] Navigáció Pt·1·2·3 |
|---|
| Kísérleti fizika 3. gyakorlat |
| Gyakorlatok listája: |
| Termodinamika - Kinetikus gázelmélet, transzportfolyamatok |
| Feladatok listája: |
| © 2012-2013 BME-TTK, TÁMOP4.1.2.A/1-11/0064 |
Feladat
- Melegszik vagy lehűl az
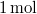 ideális gáz, ha a
ideális gáz, ha a 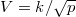 összefüggés (
összefüggés (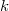 állandó) szerint tágul ki? Mekkora a gáz mólhője ebben a folyamatban, ha állandó térfogaton mért mólhője
állandó) szerint tágul ki? Mekkora a gáz mólhője ebben a folyamatban, ha állandó térfogaton mért mólhője 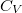 ?
?
Megoldás
A termodinamika első főtétele szerint![\[\delta Q = \mathrm{d}U+p\,\mathrm{d}V,\]](/images/math/0/9/6/09608eb0a969432fd57642dcb7e8070c.png)
ahol a belső energiát a hőmérséklet és a térfogat függvényeként fogjuk fel (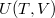 ), ezzel:
), ezzel:
![\[\delta Q = \left(\frac{\partial U}{\partial T}\right)_V\mathrm{d}T+ \left(\frac{\partial U}{\partial V}\right)_T\mathrm{d}V+ p\,\mathrm{d}V.\]](/images/math/4/5/7/4576af24ab8b23a9bf31e1fa445b3d68.png)
Az utolsó két tag sorrendjét felcserélve általánosan levezethető, hogy
![\[C n \mathrm{d}T = C_V n \mathrm{d}T+ \left[p+\frac{\partial U}{\partial V}\right]_T\mathrm{d}V.\]](/images/math/5/2/1/521ec92a9c0043e71e15664a892e20cb.png)
Az ideális gázra speciálisan a belső energia térfogat szerinti parciális deriváltja nulla. A térfogat infinitezimális megváltozását a folyamatot jellemző úton kifejezhetjük a hőmérséklettel:
![\[C n \mathrm{d}T = C_V n \mathrm{d}T+ p\left(\frac{\mathrm{d} V}{\mathrm{d} T}\right)_{\text{állapotváltozás}}\mathrm{d}T.\]](/images/math/a/5/7/a57c5ad16c6f3b0bc5e2217d82e424be.png)
Az ideális gáz 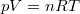 állapotegyenletéből és a folyamatot jellemző
állapotegyenletéből és a folyamatot jellemző 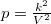 egyenletből a térfogat és a folyamatot jellemző deriváltja számítható:
egyenletből a térfogat és a folyamatot jellemző deriváltja számítható:
![\[V=\frac{k^2}{nRT}\qquad\text{és}\qquad\frac{\mathrm{d}V}{\mathrm{d}T}=-\frac{k^2}{nRT^2}\]](/images/math/e/6/d/e6dd96cd17f87c9e1b557abc59e80c18.png)
Ezt visszaírva a folyamatot jellemző 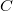 fajhő kifejezésébe azt kapjuk, hogy
fajhő kifejezésébe azt kapjuk, hogy