„Termodinamika - Fázisátalakulások” változatai közötti eltérés
A Fizipedia wikiből
(Új oldal, tartalma: „Kategória:Kísérleti fizika 3. gyakorlat Kategória:Szerkesztő:Stippinger {{Kísérleti fizika gyakorlat | tárgynév = Kísérleti fizika 3. gyakorlat | gya…”) |
|||
| 15. sor: | 15. sor: | ||
{{:Termodinamika példák - Víz forráshőjének becslése}}{{Megoldás|link=Termodinamika példák - Víz forráshőjének becslése}} | {{:Termodinamika példák - Víz forráshőjének becslése}}{{Megoldás|link=Termodinamika példák - Víz forráshőjének becslése}} | ||
{{:Termodinamika példák - Argon olvadási görbéje}}{{Megoldás|link=Termodinamika példák - Argon olvadási görbéje}} | {{:Termodinamika példák - Argon olvadási görbéje}}{{Megoldás|link=Termodinamika példák - Argon olvadási görbéje}} | ||
| − | |||
{{:Termodinamika példák - Fázisok egyensúlya szabadenergiával}}{{Megoldás|link=Termodinamika példák - Fázisok egyensúlya szabadenergiával}} | {{:Termodinamika példák - Fázisok egyensúlya szabadenergiával}}{{Megoldás|link=Termodinamika példák - Fázisok egyensúlya szabadenergiával}} | ||
A lap 2013. április 5., 20:03-kori változata
| [rejt] Navigáció Pt·1·2·3 |
|---|
| Kísérleti fizika 3. gyakorlat |
| Gyakorlatok listája: |
| Termodinamika - Fázisátalakulások |
| Feladatok listája: |
| © 2012-2013 BME-TTK, TÁMOP4.1.2.A/1-11/0064 |
Feladatok
- Mutassuk meg, hogy mechanikai- és termikus kölcsönhatásban részt vevő rendszerben állandó nyomáson végbemenő fázisátalakulásnál az átalakulási hő (
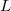 ) az entalpiaváltozással (
) az entalpiaváltozással (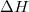 ) egyenlő!
) egyenlő!
- Mennyivel változik meg
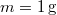 nitrogéngáz entrópiája, ha állandó nyomáson
nitrogéngáz entrópiája, ha állandó nyomáson 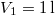 térfogatról
térfogatról 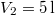 térfogatra expandáltatjuk.
térfogatra expandáltatjuk.
- Henger alakú edényben
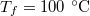 hőmérsékletű telített vízgőz van. Egy súlytalan dugattyú lassú betolásának hatására az edényben
hőmérsékletű telített vízgőz van. Egy súlytalan dugattyú lassú betolásának hatására az edényben 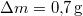 víz lecsapódik. A víz moláris tömege
víz lecsapódik. A víz moláris tömege 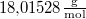 A folyamat során a nyomás a
A folyamat során a nyomás a 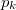 külső légnyomással egyenlő.
külső légnyomással egyenlő.
Mennyi munkát végeztünk ezalatt az ideális gáznak tekinthető vízgőzön?
- Felhasználva, hogy az olvadáspont az állandó nyomáson felvett
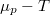 diagramban a szilárd fázisra és a folyadékra érvényes görbék metszéspontjánál van mutassuk ki, hogy a nyomás növelésekor az olvadáspont nő, ha a szilárd fázis móltérfogata kisebb, mint a folyadéké! Hogyan változik a jég olvadáspontja, a nyomás növelésekor?
diagramban a szilárd fázisra és a folyadékra érvényes görbék metszéspontjánál van mutassuk ki, hogy a nyomás növelésekor az olvadáspont nő, ha a szilárd fázis móltérfogata kisebb, mint a folyadéké! Hogyan változik a jég olvadáspontja, a nyomás növelésekor?
- A szilárd-folyadék egyensúlyi görbének (olvadási görbe) közelítő meghatározására gyakran használják a
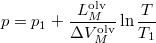 összefüggést (
összefüggést (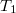 a
a 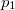 nyomáson,
nyomáson,  a
a 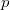 nyomáson érvényes olvadáspont, az egyenletben szereplő
nyomáson érvényes olvadáspont, az egyenletben szereplő 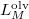 az anyag moláris átalakulási hője (vagy moláris entalpiaváltozása),
az anyag moláris átalakulási hője (vagy moláris entalpiaváltozása), 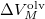 pedig a móltérfogat változása az olvadásnál).
pedig a móltérfogat változása az olvadásnál).
- a) Vezessük le ezt az egyenletet, és állapítsuk meg, hogy milyen feltételek mellett érvényes!
- b) Mutassuk ki, hogy a
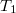 -hez képest kis
-hez képest kis  érték eseten az egyensúlyi nyomás lineárisan változik a
érték eseten az egyensúlyi nyomás lineárisan változik a  különbséggel!
különbséggel!
- Ha a nyomást
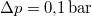 -ral megnöveljük, akkor a víz forrási hőmérséklete
-ral megnöveljük, akkor a víz forrási hőmérséklete 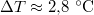 -kal növekszik. Ennek felhasználásával becsüljük meg a víz forráshőjét!
-kal növekszik. Ennek felhasználásával becsüljük meg a víz forráshőjét!
- A szilárd argon
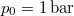 nyomáson
nyomáson 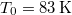 hőmérsékleten olvad meg. Olvadáshője ekkor
hőmérsékleten olvad meg. Olvadáshője ekkor 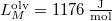 , móltérfogatának változása
, móltérfogatának változása 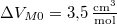 . A nyomás növekedésekor kísérleti eredmények szerint az olvadáshő nem változik, a
. A nyomás növekedésekor kísérleti eredmények szerint az olvadáshő nem változik, a 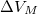 móltérfogatváltozás viszont az abszolút hőmérséklet megközelítőleg
móltérfogatváltozás viszont az abszolút hőmérséklet megközelítőleg 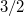 -ik hatványával arányos.
-ik hatványával arányos.
Mekkora nyomást kell alkalmaznunk ahhoz, hogy az olvadási hőmérséklet megkétszereződjék?
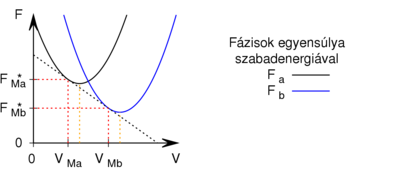
- Egy homogén anyag adott hőmérsékleten két fázisban (
 és
és 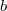 ) létezhet. Az egyes fázisok moláris szabad energiáinak térfogattól való függése (rögzített hőmérsékleten, állandó anyagmennyiség esetén) az ábrán látható.
) létezhet. Az egyes fázisok moláris szabad energiáinak térfogattól való függése (rögzített hőmérsékleten, állandó anyagmennyiség esetén) az ábrán látható.
Mutassuk ki, hogy egyensúlyi állapotban a fázisok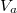 és
és 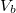 térfogatai a két görbéhez húzott közös érintő érintési pontjainak abszcisszái, a közös nyomás pedig az érintő negatív iránytangense!
térfogatai a két görbéhez húzott közös érintő érintési pontjainak abszcisszái, a közös nyomás pedig az érintő negatív iránytangense!
![\[\Delta S=\frac{m}{\mu_\mathrm{N_2}}C_p\ln\frac{V_2}{V_1}=3{,}34\,\mathrm{\frac{J}{K}}, \qquad C_p=\frac72R.\]](/images/math/6/9/3/69379145baf5ca7bc790fdc4464b8173.png)
![\[\Delta W=p_k\left(V_1-V_2\right)=\frac{RT_f}{M}\Delta m=120\,\mathrm{J}\]](/images/math/0/1/c/01c0c0abb9f739cbff493a96bc03ec39.png)
![\[\left(\frac{\partial \mu }{\partial p}\right)_T= V_M\]](/images/math/2/5/a/25a4030c915d37e859e677c758ddfc3f.png)
 -ekre érvényes
-ekre érvényes 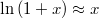 összefüggést.
összefüggést. ![\[L_f\approx \frac{\Delta p}{\Delta T}\frac{RT^2}{p_kM}=2253\,\mathrm{\frac{kJ}{kg}}\]](/images/math/4/c/7/4c7c0dfc446c66a05097776d64fc920c.png)
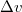 hőmérsékletfüggésének figyelembevételével integráljuk a Clausius-Clapeyron-egyenletet!
hőmérsékletfüggésének figyelembevételével integráljuk a Clausius-Clapeyron-egyenletet! ![\[p=p_0+\frac{2L}{3\Delta v_0}\left(1-\left(\frac{T_0}{T}\right)^{3/2}\right)=1449\,\mathrm{bar}\]](/images/math/b/5/9/b59affbd1e174e38c0177e77ed696768.png)
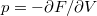 , ill.
, ill. 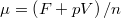 ), és használjuk ki, hogy fázisegyensúlyban a két fázis nyomása és kémiai potenciálja egyenlő!
), és használjuk ki, hogy fázisegyensúlyban a két fázis nyomása és kémiai potenciálja egyenlő!