„Termodinamika példák - Ideális gáz állapotváltozása egyenlettel” változatai közötti eltérés
A Fizipedia wikiből
(→Megoldás) |
|||
| 24. sor: | 24. sor: | ||
$$V=\frac{k^2}{nRT}\qquad\text{és}\qquad\frac{\mathrm{d}V}{\mathrm{d}T}=-\frac{k^2}{nRT^2}=-\frac{V}{T}$$ | $$V=\frac{k^2}{nRT}\qquad\text{és}\qquad\frac{\mathrm{d}V}{\mathrm{d}T}=-\frac{k^2}{nRT^2}=-\frac{V}{T}$$ | ||
Ezt visszaírva a folyamatot jellemző $C$ fajhő kifejezésébe azt kapjuk, hogy | Ezt visszaírva a folyamatot jellemző $C$ fajhő kifejezésébe azt kapjuk, hogy | ||
| − | $$C n \mathrm{d}T = (C_V n - \frac{pV}{T})\mathrm{d}T = (C_V n - nR)\mathrm{d}T,$$ | + | $$C n \mathrm{d}T = \left(C_V n - \frac{pV}{T}\right)\mathrm{d}T = (C_V n - nR)\mathrm{d}T,$$ |
ahonnan a fajhő leolvasható: | ahonnan a fajhő leolvasható: | ||
| − | $$ C = | + | $$ C = C_V - n. $$ |
</wlatex> | </wlatex> | ||
</noinclude> | </noinclude> | ||
A lap 2012. október 9., 21:09-kori változata
| [rejt] Navigáció Pt·1·2·3 |
|---|
| Kísérleti fizika 3. gyakorlat |
| Gyakorlatok listája: |
| Termodinamika - Kinetikus gázelmélet, transzportfolyamatok |
| Feladatok listája: |
| © 2012-2013 BME-TTK, TÁMOP4.1.2.A/1-11/0064 |
Feladat
- Melegszik vagy lehűl az
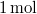 ideális gáz, ha a
ideális gáz, ha a 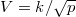 összefüggés (
összefüggés (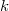 állandó) szerint tágul ki? Mekkora a gáz mólhője ebben a folyamatban, ha állandó térfogaton mért mólhője
állandó) szerint tágul ki? Mekkora a gáz mólhője ebben a folyamatban, ha állandó térfogaton mért mólhője 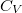 ?
?
Megoldás
A termodinamika első főtétele szerint![\[\delta Q = \mathrm{d}U+p\,\mathrm{d}V,\]](/images/math/0/9/6/09608eb0a969432fd57642dcb7e8070c.png)
ahol a belső energiát a hőmérséklet és a térfogat függvényeként fogjuk fel (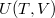 ), ezzel:
), ezzel:
![\[\delta Q = \left(\frac{\partial U}{\partial T}\right)_V\mathrm{d}T+ \left(\frac{\partial U}{\partial V}\right)_T\mathrm{d}V+ p\,\mathrm{d}V.\]](/images/math/4/5/7/4576af24ab8b23a9bf31e1fa445b3d68.png)
Az utolsó két tag sorrendjét felcserélve általánosan levezethető, hogy
![\[C n \mathrm{d}T = C_V n \mathrm{d}T+ \left[p+\frac{\partial U}{\partial V}\right]_T\mathrm{d}V.\]](/images/math/5/2/1/521ec92a9c0043e71e15664a892e20cb.png)
Az ideális gázra speciálisan a belső energia térfogat szerinti parciális deriváltja nulla. A térfogat infinitezimális megváltozását a folyamatot jellemző úton kifejezhetjük a hőmérséklettel:
![\[C n \mathrm{d}T = C_V n \mathrm{d}T+ p\left(\frac{\mathrm{d} V}{\mathrm{d} T}\right)_{\substack{\text{állapot-}\\ \text{változás}}}\mathrm{d}T.\]](/images/math/3/7/c/37cddea6d509732458ce859577c71561.png)
Az ideális gáz 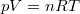 állapotegyenletéből és a folyamatot jellemző
állapotegyenletéből és a folyamatot jellemző 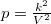 egyenletből a térfogat és a folyamatot jellemző deriváltja számítható:
egyenletből a térfogat és a folyamatot jellemző deriváltja számítható:
![\[V=\frac{k^2}{nRT}\qquad\text{és}\qquad\frac{\mathrm{d}V}{\mathrm{d}T}=-\frac{k^2}{nRT^2}=-\frac{V}{T}\]](/images/math/e/6/a/e6abcf24148c972832e6490cdf6a30c3.png)
Ezt visszaírva a folyamatot jellemző 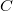 fajhő kifejezésébe azt kapjuk, hogy
fajhő kifejezésébe azt kapjuk, hogy
![\[C n \mathrm{d}T = \left(C_V n - \frac{pV}{T}\right)\mathrm{d}T = (C_V n - nR)\mathrm{d}T,\]](/images/math/d/4/2/d422977720cbbeec69ff9487c5f06749.png)
ahonnan a fajhő leolvasható:
![\[ C = C_V - n. \]](/images/math/c/a/2/ca27bfee40102b2e25755c4c5b3a47d9.png)