„Termodinamika példák - Gázcsere tartályok közt” változatai közötti eltérés
| 16. sor: | 16. sor: | ||
</noinclude><wlatex># Két azonos térfogatú tartály kacsolódik egymáshoz, a szabad úthosszhoz képest kisméretű nyíláson keresztül. Az egyikben $p_K$ nyomású hidrogéngáz, a másikban kétszer akkora nyomású hidrogéngáz van. A gázok $T$ hőmérséklete azonos és időben állandó. A kinetikus gázelmélet segítségével mutassuk ki, hogy a két tartályban azonos $p=3p_K/2$ egyensúlyi nyomás alakul ki!</wlatex><includeonly><wlatex>{{Útmutatás|content=Használjuk ki, hogy egyensúlyban az egyes edényekben a molkeulák térfogati sűrűsége állandó, és az összes molekulák száma a folyamatban nem változik.}}</wlatex></includeonly><noinclude> | </noinclude><wlatex># Két azonos térfogatú tartály kacsolódik egymáshoz, a szabad úthosszhoz képest kisméretű nyíláson keresztül. Az egyikben $p_K$ nyomású hidrogéngáz, a másikban kétszer akkora nyomású hidrogéngáz van. A gázok $T$ hőmérséklete azonos és időben állandó. A kinetikus gázelmélet segítségével mutassuk ki, hogy a két tartályban azonos $p=3p_K/2$ egyensúlyi nyomás alakul ki!</wlatex><includeonly><wlatex>{{Útmutatás|content=Használjuk ki, hogy egyensúlyban az egyes edényekben a molkeulák térfogati sűrűsége állandó, és az összes molekulák száma a folyamatban nem változik.}}</wlatex></includeonly><noinclude> | ||
== Megoldás == | == Megoldás == | ||
| − | <wlatex> | + | <wlatex>Amikor a gázcsere kis lyukon keresztül valósul meg a tartályok között, feltehetjük, hogy a gáz egy-egy tartályon belül végig egyensúlyi állapotban marad. Ha a lyuk mérete kisebb az átlagos szabad úthossznál, akkor a rajta keresztül időegység alatt távozó molekulák száma pedig megegyezik azzal, az azonos méretű tartályfalának ütközik egységnyi idő alatt. A molekulák száma az egyes tartályokban időben változik, ezt differenciálegyenlet-rendszerrel írhatjuk le: |
| + | $$ \frac{\mathrm{d}N^{(1)}}{\mathrm{d}t} = \frac14 n_V^{(2)}\langle v \rangle A - \frac14 n_V^{(1)}\langle v \rangle A,$$ | ||
| + | a molekulák átlagos sebessége $\langle v \rangle = \sqrt{\frac{8kT}{\pi \mu }}$ érelmében azonos, hiszen a két tartály hőmérséklete és töltőanyaga is azonos. | ||
| + | |||
| + | Az anyagmegmaradás értelmében a második tartályban levő molekulák száma $N^{(2)}=N-N^{(1)}$, aminek értelmében $N^{(2)}$ megváltozása is kifejezhető az előző mennyiségekkel: | ||
| + | $$ \frac{\mathrm{d}N^{(1)}}{\mathrm{d}t} = -\frac{\mathrm{d}N^{(2)}}{\mathrm{d}t}. $$ | ||
| + | |||
| + | Felhasználva ezt és, hogy $n_V^{(i)}=N^{(i)}/V^{(i)}$, ismét szétválasztható differenciálegyenletet kapunk: | ||
| + | $$ \frac{\mathrm{d}N^{(1)}}{\mathrm{d}t} = | ||
| + | - \frac14 \langle v \rangle A \left(\frac1{V^{(1)}}+\frac1{V^{(2)}}\right)N^{(1)} | ||
| + | + \frac14 \langle v \rangle A \frac{N}{V^{(2)}}$$ | ||
| + | |||
| + | Egyensúly esetén $\frac{\mathrm{d}N^{(1)}}{\mathrm{d}t}=0$: | ||
| + | |||
| + | Diszkusszió | ||
</wlatex> | </wlatex> | ||
</noinclude> | </noinclude> | ||
A lap 2013. március 30., 19:07-kori változata
| Navigáció Pt·1·2·3 |
|---|
| Kísérleti fizika 3. gyakorlat |
| Gyakorlatok listája: |
| Termodinamika - Kinetikus gázelmélet, transzportfolyamatok |
| Feladatok listája: |
| © 2012-2013 BME-TTK, TÁMOP4.1.2.A/1-11/0064 |
Feladat
- Két azonos térfogatú tartály kacsolódik egymáshoz, a szabad úthosszhoz képest kisméretű nyíláson keresztül. Az egyikben
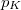 nyomású hidrogéngáz, a másikban kétszer akkora nyomású hidrogéngáz van. A gázok
nyomású hidrogéngáz, a másikban kétszer akkora nyomású hidrogéngáz van. A gázok  hőmérséklete azonos és időben állandó. A kinetikus gázelmélet segítségével mutassuk ki, hogy a két tartályban azonos
hőmérséklete azonos és időben állandó. A kinetikus gázelmélet segítségével mutassuk ki, hogy a két tartályban azonos 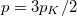 egyensúlyi nyomás alakul ki!
egyensúlyi nyomás alakul ki!
Megoldás
Amikor a gázcsere kis lyukon keresztül valósul meg a tartályok között, feltehetjük, hogy a gáz egy-egy tartályon belül végig egyensúlyi állapotban marad. Ha a lyuk mérete kisebb az átlagos szabad úthossznál, akkor a rajta keresztül időegység alatt távozó molekulák száma pedig megegyezik azzal, az azonos méretű tartályfalának ütközik egységnyi idő alatt. A molekulák száma az egyes tartályokban időben változik, ezt differenciálegyenlet-rendszerrel írhatjuk le:
![\[ \frac{\mathrm{d}N^{(1)}}{\mathrm{d}t} = \frac14 n_V^{(2)}\langle v \rangle A - \frac14 n_V^{(1)}\langle v \rangle A,\]](/images/math/5/4/8/548330c1fdff537911dc0ff82f7a2951.png)
a molekulák átlagos sebessége 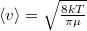 érelmében azonos, hiszen a két tartály hőmérséklete és töltőanyaga is azonos.
érelmében azonos, hiszen a két tartály hőmérséklete és töltőanyaga is azonos.
Az anyagmegmaradás értelmében a második tartályban levő molekulák száma 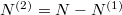 , aminek értelmében
, aminek értelmében 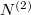 megváltozása is kifejezhető az előző mennyiségekkel:
megváltozása is kifejezhető az előző mennyiségekkel:
![\[ \frac{\mathrm{d}N^{(1)}}{\mathrm{d}t} = -\frac{\mathrm{d}N^{(2)}}{\mathrm{d}t}. \]](/images/math/1/6/c/16c0565dd0bb4bb61f994f9bde059e3a.png)
Felhasználva ezt és, hogy 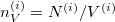 , ismét szétválasztható differenciálegyenletet kapunk:
, ismét szétválasztható differenciálegyenletet kapunk:
![\[ \frac{\mathrm{d}N^{(1)}}{\mathrm{d}t} = - \frac14 \langle v \rangle A \left(\frac1{V^{(1)}}+\frac1{V^{(2)}}\right)N^{(1)} + \frac14 \langle v \rangle A \frac{N}{V^{(2)}}\]](/images/math/c/c/3/cc3d00aae5450695cf80417461abf0c5.png)
Egyensúly esetén 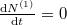 :
:
Diszkusszió