Termodinamika példák - Termodinamikai potenciálok víz elforralásakor
A Fizipedia wikiből
A lap korábbi változatát látod, amilyen Stippinger (vitalap | szerkesztései) 2013. május 24., 20:07-kor történt szerkesztése után volt.
| [rejt] Navigáció Pt·1·2·3 |
|---|
| Kísérleti fizika 3. gyakorlat |
| Gyakorlatok listája: |
| Fázisátalakulások |
| Feladatok listája: |
| © 2012-2013 BME-TTK, TÁMOP4.1.2.A/1-11/0064 |
Feladat
-
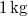 víznek normál nyomáson (
víznek normál nyomáson (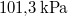 ) való elforralásához egy elektromos merülőforralón a
) való elforralásához egy elektromos merülőforralón a 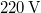 -os feszültségforrásból
-os feszültségforrásból 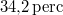 -en át
-en át 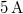 áramot kell átfolyatni. A gázállandó
áramot kell átfolyatni. A gázállandó 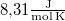 , a víz moláris tömege
, a víz moláris tömege 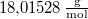 .
.
Határozzuk meg a víz- a) entalpia-,
- b) entrópia- és
- c) belső energiaváltozását ebben a folyamatban!
Megoldás
Az elforralás állandó (légköri) nyomáson és állandó (forrásponti) hőmérsékleten zajlik.
a) Az átalakulási hőről szóló feladat alapján az eltalpiaváltozás az álladó nyomáson vett átalakulási hő, ez pedig a befektetett elektromos munka:
![\[ \Delta H = \Delta Q = W_\text{el} = U_0 I_0 \Delta t \approx 2\,257\,\mathrm{kJ}. \]](/images/math/6/5/1/651ed0302a1033b574206fbaad992ca0.png)
b) Mivel a hőmérséklet állandó, az entrópiaváltozást definiáló integrál leegyszerűsödik:
![\[ \Delta S = \int_\text{kezd}^\text{vég} \mathrm{d}S = \int_{\substack{\text{átala-}\\ \text{kulás}}} \frac{\delta Q}{T} = \frac{\Delta Q}{T}\approx 6\,051 \mathrm{\frac{J}{K}}. \]](/images/math/e/7/a/e7aff39585df97e7424909af3692bafc.png)
c) Az első főtétel alapján álladó nyomáson
![\[ \Delta U=\Delta Q-p\Delta V, \]](/images/math/6/c/0/6c0cf78d3449e485e5c28af036bf8daa.png)
ahol a térfogatváltozás számításánál a gőzt mint ideális gázt tekintjük, és térfogatához képest a folyadék térfogatát elhanyagolhatjuk (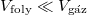 ):
):
![\[ \Delta V = V_\text{gőz}-V_\text{víz} \approx V_\text{gőz} = \frac{m}{M}\frac{RT}{p}, \]](/images/math/a/7/a/a7abd3e1fff93b6c5a1ae8983595a08d.png)
így a belső energia megváltozása
![\[ \Delta U = \Delta Q-\frac{m}{M}RT = 2\,085\,\mathrm{kJ}. \]](/images/math/3/8/e/38e1352d9002be13cd75d4cc94513312.png)