Termodinamika példák - Kémiai potenciál hőmérsékletfüggése
A Fizipedia wikiből
A lap korábbi változatát látod, amilyen Stippinger (vitalap | szerkesztései) 2013. május 24., 20:14-kor történt szerkesztése után volt.
| [rejt] Navigáció Pt·1·2·3 |
|---|
| Kísérleti fizika 3. gyakorlat |
| Gyakorlatok listája: |
| Fázisátalakulások |
| Feladatok listája: |
| © 2012-2013 BME-TTK, TÁMOP4.1.2.A/1-11/0064 |
Feladat
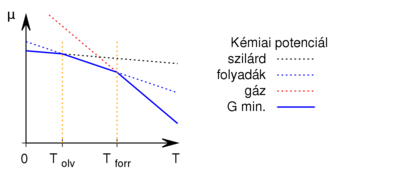
- Ábrázoljuk (kvalitatív módon) egy tiszta anyag kémiai potenciáljának
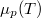 hőmérsékletfüggését állandó nyomáson, az anyag szilárd-, folyadék- és gőzállapotát átfogó hőmérséklet-intervallumban! Az olvadáspontot
hőmérsékletfüggését állandó nyomáson, az anyag szilárd-, folyadék- és gőzállapotát átfogó hőmérséklet-intervallumban! Az olvadáspontot 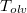 -val, a forráspontot
-val, a forráspontot 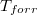 -ral jelöljük, és tegyük fel, hogy a mólentrópia egy fázison belül nem függ a hőmérséklettől!
-ral jelöljük, és tegyük fel, hogy a mólentrópia egy fázison belül nem függ a hőmérséklettől!
Megoldás
A differenciális összefüggésekről szóló feladatban tárgyaltuk a
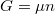 szabadentalpiára vonatkozó
szabadentalpiára vonatkozó
![\[ \left(\frac{\partial G}{\partial T}\right)_p = -S \]](/images/math/f/7/6/f76117a7dc87acddec129bb10fdbea45.png)
összefüggést, amit most a moláris entrópia és kémiai potenciál kifejezésére használunk:
![\[ \left(\frac{\partial \mu }{\partial T}\right)_p = -\frac{S}{n} = -S_M \]](/images/math/9/3/1/931c67c07d0f54be9b68a8e22ff6bb82.png)
A szilárd, folyadék és gőz halmazállapotok mólentrópiáira a rendezetlenségük avagy a lehetséges a mikroállapotok „száma” alapján fennáll, hogy:
![\[ S_M^\text{sz} < S_M^\text{foly.} < S_M^\text{gáz}, \]](/images/math/1/3/b/13b6c4eb03c4d1dcc425bafc3b0fa706.png)
amit most a halmazállapoton belül a mólentrópia hőmérsékletfüggetlenségével egészítünk ki:
![\[ \frac{\partial S_M}{\partial T} = 0. \]](/images/math/7/b/a/7baa1cac42149cf7a6f6f787285861cb.png)
Ez alapján a 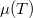 grafikon egy töröttvonal, az anyag mindig a legalacsonyabb szabadentalpiájú fázist valósítja meg:
grafikon egy töröttvonal, az anyag mindig a legalacsonyabb szabadentalpiájú fázist valósítja meg: