Termodinamika példák - Szilárd-folyadék átalakulás közelítő egyensúlyi görbéje
A Fizipedia wikiből
A lap korábbi változatát látod, amilyen Stippinger (vitalap | szerkesztései) 2013. május 28., 21:57-kor történt szerkesztése után volt.
| [rejt] Navigáció Pt·1·2·3 |
|---|
| Kísérleti fizika 3. gyakorlat |
| Gyakorlatok listája: |
| Fázisátalakulások |
| Feladatok listája: |
| © 2012-2013 BME-TTK, TÁMOP4.1.2.A/1-11/0064 |
Feladat
- A szilárd-folyadék egyensúlyi görbének (olvadási görbe) közelítő meghatározására gyakran használják a
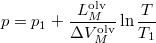 összefüggést (
összefüggést (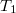 a
a 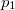 nyomáson,
nyomáson,  a
a 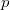 nyomáson érvényes olvadáspont, az egyenletben szereplő
nyomáson érvényes olvadáspont, az egyenletben szereplő 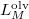 az anyag moláris átalakulási hője (vagy moláris entalpiaváltozása),
az anyag moláris átalakulási hője (vagy moláris entalpiaváltozása), 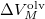 pedig a móltérfogat változása az olvadásnál).
pedig a móltérfogat változása az olvadásnál).
- a) Vezessük le ezt az egyenletet, és állapítsuk meg, hogy milyen feltételek mellett érvényes!
- b) Mutassuk ki, hogy a
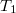 -hez képest kis
-hez képest kis  érték eseten az egyensúlyi nyomás lineárisan változik a
érték eseten az egyensúlyi nyomás lineárisan változik a  különbséggel!
különbséggel!
Megoldás
a) Két fázis egyensúlyának szükséges feltétele, hogy
![\[ p_1 = p_2 = p, \]](/images/math/6/d/c/6dc0fe3fae653683a9832e008feb0241.png)
![\[ T_1 = T_2 = T, \]](/images/math/9/8/d/98d08f065366eff6110174c21464017c.png)
![\[ \mu_1\left(p,T\right) = \mu_2\left(p,T\right) \]](/images/math/0/0/6/0060fa339b7a4fc280142bc88fd854e1.png)
A harmadik feltételből adódik, hogy az egyensúlyi görbén elmozdulva
![\[ \mathrm{d}\mu_1 = \mathrm{d}\mu_2, \]](/images/math/6/5/f/65fac2c55da9c4655d447c04f62bce42.png)
azaz a teljes differenciálok megegyeznek:
![\[ \left(\frac{\partial \mu_1}{\partial p}\right)_T\,\mathrm{d}p + \left(\frac{\partial \mu_1}{\partial T}\right)_p\,\mathrm{d}T = \left(\frac{\partial \mu_2}{\partial p}\right)_T\,\mathrm{d}p + \left(\frac{\partial \mu_2}{\partial T}\right)_p\,\mathrm{d}T. \]](/images/math/1/9/3/193df0f3ca0f2672a2017c131687be5a.png)
A kémiai potenciálra érvényes differenciális összefüggéseket behelyettesítve:
![\[ \left(S_{M2}-S_{M1}\right)\,\mathrm{d}T = \left(V_{M2}-V_{M1}\right)\,\mathrm{d}p. \]](/images/math/3/8/f/38f99111c080a03d4faf6c5b3cf31785.png)
A Clausius-Clapeyron egyenlet:
![\[ \frac{\mathrm{d}p}{\mathrm{d}T} = \frac{S_{M2}-S_{M1}}{V_{M2}-V_{M1}}. \]](/images/math/1/9/e/19ea55d898cff4c7435cb2d3ac4a7b27.png)
Az átalakulás állandó  hőmérsékleten megy végbe, így az entrópiaváltozás egyszerűen kifejezhető a redukált hővel, a Clapeyron-egyenletet nyerjük:
hőmérsékleten megy végbe, így az entrópiaváltozás egyszerűen kifejezhető a redukált hővel, a Clapeyron-egyenletet nyerjük:
![\[ \frac{\mathrm{d}p}{\mathrm{d}T} = \frac{L_M}{T\Delta V_M}. \]](/images/math/a/0/f/a0fec1a8cfebf50be3236f388d120097.png)
Ezt változószétválasztás után 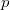 és
és  szerint kiintegrálva szilárd-folyadék fázisátmenetre, feltéve, hogy
szerint kiintegrálva szilárd-folyadék fázisátmenetre, feltéve, hogy 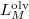 és
és 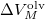 sem függ a hőmérséklettől:
sem függ a hőmérséklettől:
![\[ p = p_1+\frac{L_M^\text{olv}}{\Delta V_M^\text{olv}}\ln \frac T{T_1}. \]](/images/math/7/4/8/7484dbbd27794b9374fe617c8756df48.png)
b) Ha 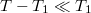 , alkalmazhatjuk
, alkalmazhatjuk 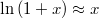 közelítést:
közelítést:
![\[ p = p_1+\frac{L_M^\text{olv}}{\Delta V_M^\text{olv}}\ln \frac{T-T_1+T_1}{T_1} = p_1+\frac{L_M^\text{olv}}{\Delta V_M^\text{olv}}\ln \left(1+\frac{T-T_1}{T_1}\right) \approx p_1+\frac{L_M^\text{olv}}{\Delta V_M^\text{olv}}\frac{T-T_1}{T_1}. \]](/images/math/0/1/f/01fdae02453d8dcc60eddb638ca79aea.png)