Termodinamika példák - Van der Waals-gáz fajhőkülönbsége
A Fizipedia wikiből
A lap korábbi változatát látod, amilyen Stippinger (vitalap | szerkesztései) 2013. április 7., 18:12-kor történt szerkesztése után volt.
Feladat
- Fejezzük ki a
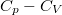 különbséget
különbséget 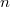 mol Van der Waals-gáz esetén a hőmérséklet, a térfogat és a
mol Van der Waals-gáz esetén a hőmérséklet, a térfogat és a 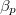 hőtágulási együttható segítségével!
hőtágulási együttható segítségével!
Megoldás
A termodinamika első főtételébe (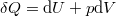 ) behelyettesítve az
) behelyettesítve az 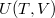 kétváltozós függvény teljes differenciálját
kétváltozós függvény teljes differenciálját
![\[ \delta Q = \left(p+\left(\frac{\partial U}{\partial V}\right)_T\right) \mathrm{d}V + \left(\frac{\partial V}{\partial T}\right)_p \mathrm{d}T \]](/images/math/c/c/9/cc9cd20e861dce7c9328d18a91ffe6fb.png)
összefüggéshez, és ezt állandó nyomáson formálisan 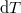 -vel osztva
-vel osztva
![\[ C_p- C_V=\frac 1 n\left(p+{\left(\frac{\partial U}{\partial V}\right)}_T\right){\left(\frac{\partial V}{\partial T}\right)}_p \]](/images/math/2/a/8/2a826accd48eda44f40a4532d0fcb231.png)
általános fajhőösszefüggéshez jutunk.
Ismerve a Van der Waals-gáz belső energiáját leíró
![\[ U=n C_VT- n^2\frac a V \]](/images/math/c/e/0/ce0c40b9dcdde793f5b86b0743cf1bc8.png)
képletet,
![\[ {\left(\frac{\partial U}{\partial V}\right)}_T=\frac{n^2a}{V^2} \]](/images/math/6/f/6/6f66d9505b74f008a73f7ed5d6f19652.png)
differenciálhányadost kiszámíthatjuk és
![\[ \beta_p = \frac{1}{V} \left(\frac{\partial V}{\partial T}\right)_p \]](/images/math/c/5/b/c5bbb1f2f4680cbba379057eed004602.png)
definíciót beírhatjuk a fajhőösszefüggésbe:
![\[ C_p-C_V=\frac{1}{n} \left(p+\frac{n^2a}{V^2}\right) V \beta_p \]](/images/math/f/5/2/f52ec36ce80d9d8dae3474ff5ad2ce06.png)
A
![\[ \left(p+\frac{n^2a}{V^2}\right)\left(V-nb\right)=nRT \]](/images/math/6/f/2/6f260623541ae94502fb9df34b7ed304.png)
van der Waals-gáz állapotegyenletből az első tényezőt kifejezve egyszerűbb kifejezéshez jutunk:
![\[ C_p- C_V=\frac{RT{\beta }_p}{\displaystyle 1-\frac{nb}{V}}.\]](/images/math/9/5/1/95195e3659fcd2167b8826609b3140a7.png)