Termodinamika példák - Ideális gáz entrópiája
| [rejt] Navigáció Pt·1·2·3 |
|---|
| Kísérleti fizika 3. gyakorlat |
| Gyakorlatok listája: |
| Entrópia, II. főtétel |
| Feladatok listája: |
| © 2012-2013 BME-TTK, TÁMOP4.1.2.A/1-11/0064 |
Feladat
- Az ideális gáz entrópiáját gyakran az
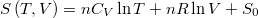 alakban használják.
alakban használják.
- a) Indokolja meg, hogy az
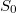 mennyiségnek függnie kell a rendszer anyagmennyiségét megadó n mólszámtól!
mennyiségnek függnie kell a rendszer anyagmennyiségét megadó n mólszámtól!
- b) Adjon meg egy olyan
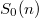 -függést, amellyel az entrópia fenti kifejezése teljesíti az a) pontban szereplő követelményt!
-függést, amellyel az entrópia fenti kifejezése teljesíti az a) pontban szereplő követelményt!
- a) Indokolja meg, hogy az
Megoldás
a) Az entrópia extenzív mennyiség, ezért egy nagyobb rendszer entrópiája a részrendszerek entrópiájának összege. Ez az additivitás csak úgy teljesülhet, ha az 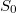 referenciaérték függ a rendszer nagyságától, azaz a mólszámtól.
referenciaérték függ a rendszer nagyságától, azaz a mólszámtól.
Megjegyzés
A feladatban megadott képletben 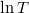 és
és 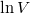 csak dimenzió nélkül (előre rögzített
csak dimenzió nélkül (előre rögzített 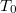 és
és 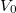 egységekben mért mértékegység nélküli számként) értelmezhetőek, ahogy az előző feladatban megállapítottuk:
egységekben mért mértékegység nélküli számként) értelmezhetőek, ahogy az előző feladatban megállapítottuk:
![\[ S\left(T,V,n\right)- S_0(n)=n\left( C_V \ln T + R\ln V \right)\]](/images/math/b/9/5/b9553d68d845abb7505115aa06356f25.png)
b) Mivel az entrópia extenzív mennyiség, egyensúlyban felírható egy extenzív mennyiség (pl. mólszám) és intenzív mennyiségek összegének szorzataként. Intenzívnek tekintendőek a moláris- és sűrűségjellegű mennyiségek is.
Tegyük a térfogatot is molárissá, így leválaszthatjuk a mólszámtól való függést:
![\[ S\left(T,V,n\right) = n\left( C_V \ln T + R\ln \frac{V}{n} + R\ln n +\frac{S_0(n)}{n} \right) = n\left( C_V \ln T + R\ln V_M + s_0 \right), \]](/images/math/e/4/b/e4b84fa24b405361acf517f93bfdba05.png)
ahol a zárójelben már intenzív mennyiségek állnak: 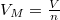 moláris térfogat és
moláris térfogat és 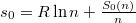 már független a mólszámtól, és beazonosíthatjuk, hogy
már független a mólszámtól, és beazonosíthatjuk, hogy
![\[ S_0(n)=-nR\ln n+ns_0. \]](/images/math/b/1/d/b1dc646b453328d8e2956b16892eeb32.png)