Termodinamika példák - Olvadáspont eltolódása nyomásváltozásra
A Fizipedia wikiből
A lap korábbi változatát látod, amilyen Stippinger (vitalap | szerkesztései) 2013. április 20., 17:35-kor történt szerkesztése után volt.
| [rejt] Navigáció Pt·1·2·3 |
|---|
| Kísérleti fizika 3. gyakorlat |
| Gyakorlatok listája: |
| Fázisátalakulások |
| Feladatok listája: |
| © 2012-2013 BME-TTK, TÁMOP4.1.2.A/1-11/0064 |
Feladat
- Felhasználva, hogy az olvadáspont az állandó nyomáson felvett
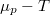 diagramban a szilárd fázisra és a folyadékra érvényes görbék metszéspontjánál van mutassuk ki, hogy a nyomás növelésekor az olvadáspont nő, ha a szilárd fázis móltérfogata kisebb, mint a folyadéké! Hogyan változik a jég olvadáspontja, a nyomás növelésekor?
diagramban a szilárd fázisra és a folyadékra érvényes görbék metszéspontjánál van mutassuk ki, hogy a nyomás növelésekor az olvadáspont nő, ha a szilárd fázis móltérfogata kisebb, mint a folyadéké! Hogyan változik a jég olvadáspontja, a nyomás növelésekor?
Megoldás
A differenciális összefüggésekről szóló feladatban tárgyaltuk a
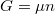 szabadentalpiára vonatkozó
szabadentalpiára vonatkozó
![\[ \left(\frac{\partial G}{\partial p}\right)_T = V \]](/images/math/8/9/f/89f2acfca3b04eb95608e4c9f6746b6f.png)
összefüggést, amit most a moláris entrópia és kémiai potenciál kifejezésére használunk:
![\[ \left(\frac{\partial \mu }{\partial p}\right)_T=\frac V n = V_M.\]](/images/math/1/b/c/1bce37c639e0131c3d9d1abecef914ec.png)
Az anyagok többségének a moláris térfogata szilárd fázisban kisebb, mint folyadék fázisban:
![\[ V_M^\text{sz} < V_M^\text{foly},\]](/images/math/8/d/5/8d51b93a40055436dad9bc6e3a11f7cc.png)
azaz
![\[ \left(\frac{\partial \mu }{\partial p}\right)_T^\text{sz}< \left(\frac{\partial \mu }{\partial p}\right)_T^\text{foly}. \]](/images/math/c/0/f/c0f73f7b586e412b3b19bc3fde0e77a6.png)
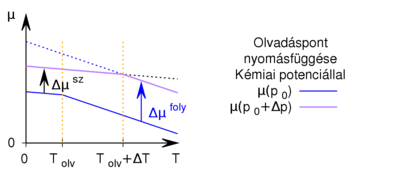
Ez azt jelenti, hogy az előző feladatban felvázolt 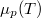 görbéből úgy kapjuk a nagyobb nyomáshoz tartozó görbét, ha minden egyes
görbéből úgy kapjuk a nagyobb nyomáshoz tartozó görbét, ha minden egyes  értékhez rendelt
értékhez rendelt 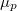 pontot megnövelünk egy állandó
pontot megnövelünk egy állandó 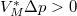 értékkel, de növelés mértéke a folyadék fázisban nagyobb, mint a szilárdban:
értékkel, de növelés mértéke a folyadék fázisban nagyobb, mint a szilárdban:
Látszik, hogy a két egyenes új metszéspontja 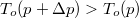 .
.
Víznél fagyáskor jelentős térfogatnövekedés lép fel, 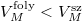 , ugyanezen szerkesztési menetet követve látható, hogy
, ugyanezen szerkesztési menetet követve látható, hogy 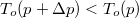 , azaz az új olvadáspont kisebb lesz.
, azaz az új olvadáspont kisebb lesz.