Termodinamika példák - Vákuum
A Fizipedia wikiből
A lap korábbi változatát látod, amilyen Stippinger (vitalap | szerkesztései) 2013. április 26., 22:02-kor történt szerkesztése után volt.
| [rejt] Navigáció Pt·1·2·3 |
|---|
| Kísérleti fizika 3. gyakorlat |
| Gyakorlatok listája: |
| Kinetikus gázelmélet, transzport |
| Feladatok listája: |
| © 2012-2013 BME-TTK, TÁMOP4.1.2.A/1-11/0064 |
Feladat
- Legfeljebb mekkora lehet az
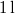 térfogatú, gömb alakú edényben lévő
térfogatú, gömb alakú edényben lévő 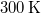 -es hidrogéngáz nyomása, hogy az átlagos szabad úthossz nagyobb legyen az edény átmérőjénél? A hidrogénmolekula átmérője
-es hidrogéngáz nyomása, hogy az átlagos szabad úthossz nagyobb legyen az edény átmérőjénél? A hidrogénmolekula átmérője 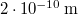 .
.
Megoldás
Az átlagos szabad úthossz
![\[ \langle l \rangle = \frac{1}{\sqrt{2}\, n_V \sigma}, \]](/images/math/9/6/8/968abed9f5d783ba1de1a0499fb8b170.png)
ahol 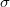 a részecskék ütközési hatáskeresztmetszete,
a részecskék ütközési hatáskeresztmetszete, 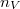 pedig a gáz molekulaszám-sűrűsége. Klasszikus kinetikus modellben a szórási hatáskeresztmetszetet a molekulák, mint „kemény gömbök” vetületi területével adjuk meg, amit a
pedig a gáz molekulaszám-sűrűsége. Klasszikus kinetikus modellben a szórási hatáskeresztmetszetet a molekulák, mint „kemény gömbök” vetületi területével adjuk meg, amit a 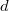 molekulaátmérővel fejezhetünk ki:
molekulaátmérővel fejezhetünk ki:
![\[ \sigma = d^2 \pi. \]](/images/math/c/2/2/c224eeccfeb0354f9a5e3b7f5000a234.png)
Az ideális gáz 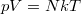 állapotegyenletéből meghatározhatjuk a molekulaszám-sűrűséget:
állapotegyenletéből meghatározhatjuk a molekulaszám-sűrűséget:
![\[ n_V = \frac{N}{V} = \frac{p}{kT}. \]](/images/math/c/1/a/c1a40043f09c0af59b72b95d836aead7.png)
A 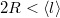 feltétel az átlagos szabad úthosszban szereplő mennyiségeket behelyettesítve:
feltétel az átlagos szabad úthosszban szereplő mennyiségeket behelyettesítve:
![\[ 2R < \frac{kT}{\sqrt{2}\, p \, d^2\pi}, \]](/images/math/b/7/2/b72c107c84fbe2cc19a3371601fbdd24.png)
amiből átrendezéssel a nyomás:
![\[ p < \frac{kT}{2\sqrt{2}\, R \, d^2\pi}. \]](/images/math/f/b/f/fbff4805161646aaaaa2dac2526147af.png)
A megadott 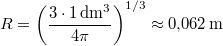 ,
, 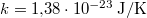 ,
, 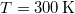 és
és 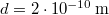 numerikus értékekkel
numerikus értékekkel 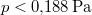 .
.