Termodinamika példák - Ideális gáz egy körfolyamata adiabatával
A Fizipedia wikiből
| [rejt] Navigáció Pt·1·2·3 |
|---|
| Kísérleti fizika 3. gyakorlat |
| Gyakorlatok listája: |
| Fajhő, Körfolyamatok |
| Feladatok listája: |
| © 2012-2013 BME-TTK, TÁMOP4.1.2.A/1-11/0064 |
Feladat
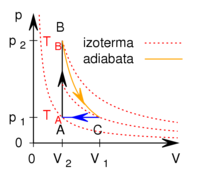
- Az ábrán a
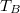 és
és 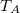 hőmérsékletekkel meghatározott körfolyamat látható. Mekkora annak a gépnek a hatásfoka, amelyik ezt a körfolyamatot mólnyi mennyiségű, adott
hőmérsékletekkel meghatározott körfolyamat látható. Mekkora annak a gépnek a hatásfoka, amelyik ezt a körfolyamatot mólnyi mennyiségű, adott 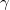 fajhőviszonyú ideális gázzal valósítja meg?
fajhőviszonyú ideális gázzal valósítja meg?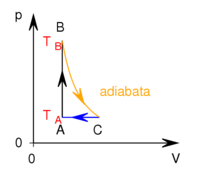
Megoldás
A hőerőgép hatásfoka
![\[ \eta = \frac{\Delta W}{\Delta Q_\text{fel}} = \frac{\Delta Q_\text{fel} - |\Delta Q_\text{le}|}{\Delta Q_\text{fel}} = 1-\frac{|\Delta Q_\text{le}|}{\Delta Q_\text{fel}}.\]](/images/math/a/7/3/a7358065651d9b1c71ca0ac92979bc46.png)
Adiabatától eltérő görbén mozgó rendszer, környezetével hőcserét végez. Jelen körüljárási iránnyal ez az izobár 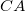 szakaszon
szakaszon 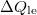 hőleadás, az izochor
hőleadás, az izochor 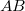 szakaszon pedig
szakaszon pedig 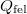 hőfelvétel:
hőfelvétel:
![\[ \Delta Q_\text{le}=n C_p\left( T_C- T_A\right), \]](/images/math/a/d/3/ad3d3f0ab808de2e77000f5d22352f35.png)
![\[ \Delta Q_\text{fel}=n C_V\left( T_B- T_A\right), \]](/images/math/7/4/c/74c17f4e6f6a12874ff692c588851a78.png)
behelyettesítve a hatásfok definíciójába:
![\[ \eta= 1-\gamma \frac{T_C-T_A}{T_B-T_A}. \]](/images/math/1/b/1/1b1f6033b1282f28b5519b0e1ba5bf16.png)
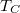 -t az adiabata egyenletéből a térfogat és a hőmérséklet segítségével kifejezhetjük:
-t az adiabata egyenletéből a térfogat és a hőmérséklet segítségével kifejezhetjük:
![\[ T_C V_2^{\gamma-1} = T_B V_1^{\gamma-1} \qquad \Rightarrow \qquad T_C = T_B{\left(\frac{V_1}{V_2}\right)}^{\gamma -1}, \]](/images/math/c/e/0/ce0ef8f0ce2d19fcd41e7f6811dd5934.png)
amit az izobár kompresszió 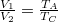 paramétereinek ismeretében visszavezethetünk a megadott hőmérsékletekre:
paramétereinek ismeretében visszavezethetünk a megadott hőmérsékletekre:
![\[ T_C^{\gamma }= T_B T_A^{\gamma -1}. \]](/images/math/3/3/3/3336d34d66f9103d16b8f423c113d8db.png)
A hatásfok 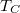 kifejezését behelyettesítve:
kifejezését behelyettesítve:
![\[ \eta =1-\gamma \frac{T_B^{\frac 1{\gamma }} T_A^{\frac{\gamma -1}{\gamma }}- T_A}{T_B- T_A}=1-\gamma \frac{{\left(\frac{T_B}{T_A}\right)}^{\frac 1{\gamma }}-1}{\frac{T_B}{T_A}-1}.\]](/images/math/d/4/4/d4404aec8620e78f36e42f0f6504c4ff.png)