„Termodinamika példák - Ideális gáz állapotváltozása egyenlettel” változatai közötti eltérés
A Fizipedia wikiből
(Új oldal, tartalma: „<noinclude> Kategória:Kísérleti fizika 3. gyakorlat Kategória:Szerkesztő:Stippinger Kategória:Termodinamika [[Kategória:Termodinamika - Kinetikus gázel…”) |
a |
||
| (egy szerkesztő 9 közbeeső változata nincs mutatva) | |||
| 3. sor: | 3. sor: | ||
[[Kategória:Szerkesztő:Stippinger]] | [[Kategória:Szerkesztő:Stippinger]] | ||
[[Kategória:Termodinamika]] | [[Kategória:Termodinamika]] | ||
| − | |||
{{Kísérleti fizika gyakorlat | {{Kísérleti fizika gyakorlat | ||
| tárgynév = Kísérleti fizika 3. gyakorlat | | tárgynév = Kísérleti fizika 3. gyakorlat | ||
| − | | témakör = Termodinamika - | + | | témakör = Termodinamika - Fajhő, Körfolyamatok |
}} | }} | ||
== Feladat == | == Feladat == | ||
| − | </noinclude><wlatex># Melegszik vagy lehűl az $1\,\mathrm{mol}$ ideális gáz, ha a $V=k/\sqrt{p}$ összefüggés ($k$ állandó) szerint tágul ki? Mekkora a gáz mólhője ebben a folyamatban, ha állandó térfogaton mért mólhője $C_V$?</wlatex><includeonly><wlatex>{{Végeredmény|content=Lehűl, $$C=C_V-R$$}}</wlatex></includeonly><noinclude> | + | </noinclude><wlatex># Melegszik vagy lehűl az $1\,\mathrm{mol}$ ideális gáz, ha a $V=k/\sqrt{p}$ összefüggés ($k$ állandó) szerint tágul ki? Mekkora a gáz mólhője ebben a folyamatban, ha állandó térfogaton mért mólhője $C_V$?</wlatex><includeonly><wlatex>{{Útmutatás|content=A fajhő általános definícióját használjuk, majd az állapotváltozás „pályáját” megadó egyenlet segítségével keressük meg a $V=V(T)$ függvényt és abból a $\mathrm{d}V/\mathrm{d}T$ hányadost!}}{{Végeredmény|content=Lehűl, $$C=C_V-R$$}}</wlatex></includeonly><noinclude> |
| + | |||
== Megoldás == | == Megoldás == | ||
| − | <wlatex>A termodinamika első | + | <wlatex>A termodinamika első főtételébe ($\delta Q = \mathrm{d}U+p\,\mathrm{d}V$) behelyettesítve az $U(T,V)$ kétváltozós függvény teljes differenciálját: |
| − | + | $$ \delta Q = \left(\frac{\partial U}{\partial T}\right)_V\,\mathrm{d}T | |
| − | $$\delta Q = \left(\frac{\partial U}{\partial T}\right)_V\mathrm{d}T | + | + \left(\frac{\partial U}{\partial V}\right)_T \,\mathrm{d}V + p\,\mathrm{d}V. $$ |
| − | \left(\frac{\partial U}{\partial V}\right)_T\mathrm{d}V+ p\,\mathrm{d}V.$$ | + | Az utolsó két tag sorrendjét felcserélve ''általánosan'' igaz, hogy |
| + | $$ C n \mathrm{d}T = C_V n \,\mathrm{d}T | ||
| + | + \left[p+\frac{\partial U}{\partial V}\right]_T\,\mathrm{d}V. $$ | ||
| + | Az ''ideális gázra speciálisan'' a belső energia térfogat szerinti parciális deriváltja nulla. A térfogat infinitezimális megváltozását a folyamatot jellemző pályán kifejezhetjük a hőmérséklettel: | ||
| + | $$ C n \,\mathrm{d}T = C_V n \,\mathrm{d}T | ||
| + | + p \left(\frac{\mathrm{d} V}{\mathrm{d} T}\right)_{\substack{\text{állapot-}\\ \text{változás}}} \,\mathrm{d}T. $$ | ||
| + | Az ideális gáz $pV=nRT$ állapotegyenletéből és a folyamatra jellemző $p=\frac{k^2}{V^2}$ egyenletből a térfogat és a folyamatot jellemző deriváltja rendre | ||
| + | $$ V = \frac{k^2}{nRT}\qquad\text{és}\qquad\frac{\mathrm{d}V}{\mathrm{d}T}=-\frac{k^2}{nRT^2}=-\frac{V}{T}. $$ | ||
| + | Ezt visszaírva a folyamatot jellemző $C$ fajhő kifejezésébe azt kapjuk, hogy | ||
| + | $$ C n \,\mathrm{d}T = \left(C_V n - \frac{pV}{T}\right) \,\mathrm{d}T = (C_V n - nR)\,\mathrm{d}T, $$ | ||
| + | ahonnan a fajhő leolvasható: | ||
| + | $$ C = C_V - R. $$ | ||
</wlatex> | </wlatex> | ||
</noinclude> | </noinclude> | ||
A lap jelenlegi, 2013. május 2., 15:24-kori változata
| [rejt] Navigáció Pt·1·2·3 |
|---|
| Kísérleti fizika 3. gyakorlat |
| Gyakorlatok listája: |
| Termodinamika - Fajhő, Körfolyamatok |
| Feladatok listája: |
| © 2012-2013 BME-TTK, TÁMOP4.1.2.A/1-11/0064 |
Feladat
- Melegszik vagy lehűl az
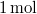 ideális gáz, ha a
ideális gáz, ha a 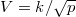 összefüggés (
összefüggés (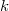 állandó) szerint tágul ki? Mekkora a gáz mólhője ebben a folyamatban, ha állandó térfogaton mért mólhője
állandó) szerint tágul ki? Mekkora a gáz mólhője ebben a folyamatban, ha állandó térfogaton mért mólhője 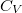 ?
?
Megoldás
A termodinamika első főtételébe (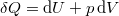 ) behelyettesítve az
) behelyettesítve az 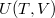 kétváltozós függvény teljes differenciálját:
kétváltozós függvény teljes differenciálját:
![\[ \delta Q = \left(\frac{\partial U}{\partial T}\right)_V\,\mathrm{d}T + \left(\frac{\partial U}{\partial V}\right)_T \,\mathrm{d}V + p\,\mathrm{d}V. \]](/images/math/7/3/c/73c339dec03dc7377de42068e73bf8e6.png)
Az utolsó két tag sorrendjét felcserélve általánosan igaz, hogy
![\[ C n \mathrm{d}T = C_V n \,\mathrm{d}T + \left[p+\frac{\partial U}{\partial V}\right]_T\,\mathrm{d}V. \]](/images/math/2/6/1/261e3c16ae77eba26202f6d5bb27b4e9.png)
Az ideális gázra speciálisan a belső energia térfogat szerinti parciális deriváltja nulla. A térfogat infinitezimális megváltozását a folyamatot jellemző pályán kifejezhetjük a hőmérséklettel:
![\[ C n \,\mathrm{d}T = C_V n \,\mathrm{d}T + p \left(\frac{\mathrm{d} V}{\mathrm{d} T}\right)_{\substack{\text{állapot-}\\ \text{változás}}} \,\mathrm{d}T. \]](/images/math/f/f/f/fffab0e7dce820f0f03bb8cfa841d4ac.png)
Az ideális gáz 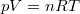 állapotegyenletéből és a folyamatra jellemző
állapotegyenletéből és a folyamatra jellemző 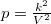 egyenletből a térfogat és a folyamatot jellemző deriváltja rendre
egyenletből a térfogat és a folyamatot jellemző deriváltja rendre
![\[ V = \frac{k^2}{nRT}\qquad\text{és}\qquad\frac{\mathrm{d}V}{\mathrm{d}T}=-\frac{k^2}{nRT^2}=-\frac{V}{T}. \]](/images/math/8/a/b/8ab26da07056d00865b9ded970ed1282.png)
Ezt visszaírva a folyamatot jellemző 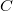 fajhő kifejezésébe azt kapjuk, hogy
fajhő kifejezésébe azt kapjuk, hogy
![\[ C n \,\mathrm{d}T = \left(C_V n - \frac{pV}{T}\right) \,\mathrm{d}T = (C_V n - nR)\,\mathrm{d}T, \]](/images/math/e/3/a/e3a584da4636705390416c209df9eaf9.png)
ahonnan a fajhő leolvasható:
![\[ C = C_V - R. \]](/images/math/7/0/9/709f46d09ed36f79c2fe6fed6ded0f33.png)