Termodinamika példák - Ideális gáz állapotváltozása p-V összefüggéssel
| Navigáció Pt·1·2·3 |
|---|
| Kísérleti fizika 3. gyakorlat |
| Gyakorlatok listája: |
| Termodinamika - Fajhő, Körfolyamatok |
| Feladatok listája: |
| © 2012-2013 BME-TTK, TÁMOP4.1.2.A/1-11/0064 |
Feladat
- Ideális gáz állapotváltozását a
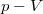 síkon a
síkon a 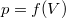 összefüggés írja le.
összefüggés írja le.
- a) Bizonyítsa be, hogy ebben a folyamatban a fajhő térfogatfüggését a összefüggés adja meg!
![\[C(V)=C_V+R\frac{f(V)}{f(V)+\frac{\mathrm{d}f}{\mathrm{d}V}}\]](/images/math/e/6/f/e6f43c6f8439c696cb747482d596e6b2.png)
- b) Milyen
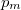 ,
, 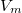 értékpárnál maximális a gáz hőmérséklete, ha az állapotváltozást a
értékpárnál maximális a gáz hőmérséklete, ha az állapotváltozást a 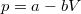 egyenlet adja meg (
egyenlet adja meg ( és
és 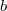 ismert pozitív állandók)?
ismert pozitív állandók)?
- a) Bizonyítsa be, hogy ebben a folyamatban a fajhő térfogatfüggését a
Megoldás
a) Egy tetszőleges folyamat során mérhető fajhő meghatározásához vissza kell nyúlnunk annak a közölt hőmennyiséggel adott 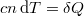 definíciójához, ezt pedig az I. főtételből tudjuk számítani:
definíciójához, ezt pedig az I. főtételből tudjuk számítani:
![\[ \delta Q = \mathrm{d}U + p\,\mathrm{d}V \]](/images/math/1/6/3/1635c527bc6dbb6f3ab31c4de2e96f72.png)
![\[ c n\,\mathrm{d}T = c_V n\,\mathrm{d}T + p\,\mathrm{d}V \]](/images/math/6/9/7/69718f7f00c621f3c8996411f646c4c8.png)
![\[ c = c_V + \frac1n p \left[\frac{\mathrm{d}V}{\mathrm{d}T}\right]_{\substack{\text{állapot-}\\ \text{változás}}} \]](/images/math/7/9/9/799407f8aa60b820ce1437a76172adad.png)
A 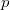 nyomáűs adott az
nyomáűs adott az 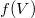 függvénykapcsolattal, még a fenti, állapotváltozás pályáján vett deriváltat kell ezzel kifejeznünk. Induljunk ki az ideális gáz állapotegyenletéből!
függvénykapcsolattal, még a fenti, állapotváltozás pályáján vett deriváltat kell ezzel kifejeznünk. Induljunk ki az ideális gáz állapotegyenletéből!
![\[ pV = nRT \]](/images/math/c/f/8/cf82310eb0f39095dfac7e50cefcd7d1.png)
Innen küszöböljük ki a 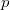 változót az állapotváltozásra vonatkozó ismereteink segítségével:
változót az állapotváltozásra vonatkozó ismereteink segítségével:
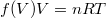 Ebből
Ebből 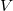 csak implicit módon volna kifejezhető, ezért az eredeti derivált helyett
csak implicit módon volna kifejezhető, ezért az eredeti derivált helyett
![\[\left[\frac{\mathrm{d}T}{\mathrm{d}V}\right]_{\substack{\text{állapot-}\\ \text{változás}}} = \left\{\left[\frac{\mathrm{d}V}{\mathrm{d}T}\right]_{\substack{\text{állapot-}\\ \text{változás}}}\right\}^{-1}\]](/images/math/e/7/b/e7b0dc98f7ef3c787bdda19db379af74.png)
értéket számítjuk ki. (Fontos megjegyezni, hogy a deriváltak ilyen kapcsolata akkor és csak akkor áll fenn, ha a deriváltak léteznek és azonos pályára számítjuk őket.)
![\[T=\frac{f(V)V}{nR} \qquad \Rightarrow \qquad \left[\frac{\mathrm{d}T}{\mathrm{d}V}\right]_{\substack{\text{állapot-}\\ \text{változás}}} = \frac1{nR}\left(\frac{\mathrm{d}f}{\mathrm{d}V}V+f\right).\]](/images/math/d/d/6/dd6130610a28a6f9a921879ac3306e46.png)
Ide behelyettesítve
![\[ c = c_V + \frac{f}{n} \frac{nR}{\frac{\mathrm{d}f}{\mathrm{d}V}V+f} \]](/images/math/8/c/2/8c2e37497b158a149c9c2448b5f78440.png)
adódik, amiből már egyenesen következik a feladat állítása.
b) Felhasználjuk a hőmérsékletre az előbb levezetett összefüggést, amibe most beírjuk 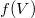 explicit alakját:
explicit alakját:
![\[T=\frac{(a-bV)V}{nR}.\]](/images/math/c/9/5/c95728a5374423764210180abb8cc207.png)
Ennek a kifejezésnek 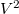 negatív együtthatója miatt maximuma van, ami szélsőértékkereséssel határozható meg:
negatív együtthatója miatt maximuma van, ami szélsőértékkereséssel határozható meg:
![\[0=\left.\frac{\partial T}{\partial V}\right|_{V_m} = \left.\frac{a-2bV}{nR}\right|_{V_m} \qquad \Rightarrow \qquad V_m=\frac{a}{2b}.\]](/images/math/b/2/2/b22cc05f46cfbd52d57e84d054981f51.png)
Innen a nyomás
![\[p_m=f(V_m)=a-\frac{a}{2}=\frac{a}{2}.\]](/images/math/c/8/e/c8ed94caf1f4039a53b2b4b460edc02d.png)