Termodinamika példák - Ideális gáz állandó mólhőjű folyamatai
A Fizipedia wikiből
A lap korábbi változatát látod, amilyen Stippinger (vitalap | szerkesztései) 2013. április 7., 22:38-kor történt szerkesztése után volt.
| Navigáció Pt·1·2·3 |
|---|
| Kísérleti fizika 3. gyakorlat |
| Gyakorlatok listája: |
| Termodinamika - Fajhő, Körfolyamatok |
| Feladatok listája: |
| © 2012-2013 BME-TTK, TÁMOP4.1.2.A/1-11/0064 |
Feladat
- Határozzuk meg azon lehetséges folyamatokat megadó összefüggést, amelyek közben az ideális gáz mólhője állandó (az állandó nyomáson és állandó térfogaton mért mólhőket tekintsük ismertnek)! Vezessük le a kapott egyenletből az ismert, állandó mólhőjű speciális folyamatok egyenletét.
Megoldás
Az ideális gáz általános fajhőjére az előző feladatbanbizonyítottuk, hogy
![\[C n \mathrm{d}T = C_V n \mathrm{d}T+ p\left(\frac{\mathrm{d} V}{\mathrm{d} T}\right)_{\substack{\text{állapot-}\\ \text{változás}}}\mathrm{d}T,\]](/images/math/1/0/0/100cdb4a5be76a6566a3ea150a1f6bb3.png)
küszöböljük ki 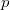 -t az állapotegyenlet segítségével (
-t az állapotegyenlet segítségével (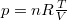 ),
),
![\[ \frac{C-C_V}{R} \frac{\mathrm{d}T}{T} = \frac{\mathrm{d}V}{V},\]](/images/math/c/8/b/c8b21e1c1438b8c835e8e223ef40c26d.png)
és integráljunk az állapotváltozás vonalán:
![\[ \frac{C-C_V}{R} \ln T = \ln V + \ln \mathrm{const.} \]](/images/math/e/1/0/e10364369ab20b2df73841117c64f134.png)
Mivel 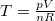 , ez
, ez
![\[ p = \mathrm{const.} V^{\textstyle \frac{R}{C-C_V}-1} = \mathrm{const.} V^{\textstyle \frac{C_p-C}{C-C_V}} \]](/images/math/7/2/1/7210f50d5b5ec873d01bdc91b9de4bb9.png)
egyenletre vezet, az állandó fajhőjű folyamatokat állandó nyomáson és térfogaton mért fajhőkkel jellemző összefüggés pedig
![\[ pV^{\textstyle \frac{C_p-C}{C_V-C}} = \mathrm{const.}. \]](/images/math/7/d/b/7db464c6f224d2b1a54db3a122a317d6.png)
Megjegyzés
Ugyanerre az eredményre eljuthatunk a következő feladatban bizonyítandó
![\[ C(V) = C_V + \frac R{1+\frac V p\frac{\mathrm{d}p}{\mathrm{d}V}} \]](/images/math/c/a/3/ca32025be9a42b79ef7b81aebb654a7f.png)
öszefüggésből indulva is. Feltéve, hogy a fajhő állandó, a kifejezésben szereplő tört nevezője is állandó:
![\[ \frac V p\frac{\mathrm{d}p}{\mathrm{d}V} = A.\]](/images/math/1/3/6/136f26b957856f12d6973555ed8dd4df.png)
A változókat szétválasztva és integrálva
![\[\frac{\mathrm{d}p} p=A\frac{\mathrm{d}V} V\]](/images/math/f/6/3/f6347da0cb1c6f66f59258ebd1fec7aa.png)
![\[ \ln \frac p{p_0}=A\ln \frac V{V_0} \]](/images/math/d/2/6/d26464fec51c5bafb87c2551d642a95e.png)
![\[ p= p_0{\left(\frac V{V_0}\right)}^A \]](/images/math/1/2/0/120bf0cef320e39b1a2e35b5201bdee0.png)
A bevezetett állandót kifejezhetjük
![\[ C(V) =C_V+\frac{R}{1+A}\]](/images/math/a/f/0/af0d213b60c976fda81233e78d1310bf.png)
egyenletből:
![\[A=\frac R{C-C_V}-1=\frac{C_p-C}{C-C_V}, \]](/images/math/a/2/d/a2d289509e32e25457aa71b4a8e6e5f2.png)
amivel
![\[ p V^{\textstyle \frac{C-C_p}{C-C_V}}=\mathrm{const.}\]](/images/math/7/9/0/790b5104248451f675c6850cb5e3ba8b.png)