„Termodinamika példák - Ideális gáz egy körfolyamata izotermával” változatai közötti eltérés
A Fizipedia wikiből
| 13. sor: | 13. sor: | ||
#* c) Mekkora a gáz által végzett munka és a gáz által felvett hő a teljes körfolyamatban?</wlatex><includeonly><wlatex>{{Végeredmény|content=a) $$\Delta U_1 = p_1 \frac{V_2-V_1}{\gamma-1}, \qquad \gamma=\frac75$$<br />b) $$\Delta Q_2=-\Delta U_1$$<br />c) $$\Delta W = \Delta Q = p(V_2-V_1)+p_1V_1\ln\left(\frac{V_1}{V_2}\right)$$}}</wlatex></includeonly><noinclude> | #* c) Mekkora a gáz által végzett munka és a gáz által felvett hő a teljes körfolyamatban?</wlatex><includeonly><wlatex>{{Végeredmény|content=a) $$\Delta U_1 = p_1 \frac{V_2-V_1}{\gamma-1}, \qquad \gamma=\frac75$$<br />b) $$\Delta Q_2=-\Delta U_1$$<br />c) $$\Delta W = \Delta Q = p(V_2-V_1)+p_1V_1\ln\left(\frac{V_1}{V_2}\right)$$}}</wlatex></includeonly><noinclude> | ||
== Megoldás == | == Megoldás == | ||
| − | <wlatex>A | + | <wlatex>A kétatomos ideális gázt $f=5$ szabadsági fok és $\gamma=\frac{f+2}{f}=\frac{7}{5}$ fajhőviszony jellemzi. Az egyes utakat $U$, $Q$ és $W$ esetében alsó indexben jelöljük. |
| + | * a) Az idális gáz belső energiája kifejezhető a hőmérséklettel, amit pedig az állapotegyenlet segítségével tudunk a megadott adatokra visszavezetni: <!-- | ||
| + | --> $$\Delta U_1=\frac{f}{2}nR\left(T_2-T_1\right)=\frac{f}{2}p_1\left(V_2-V_1\right).$$ | ||
| + | * b) Izochor átalakulás során nincs térfogati munka, azaz az I. főtétel $\Delta Q_2 = \Delta U_2$ alakot ölti. Mivel a kezdeti hőmérsékletre térünk vissza $\Delta Q_2 = \Delta U_2 = -\Delta U_1$. | ||
| + | * c) | ||
| + | <!-- | ||
| + | <center><math>\oint \delta Q=\stackrel{0}{\stackrel{⏞}{\oint \mathit{dU}}}+\oint {\mathit{dW}}_{\mathit{g\acute{a}z}}=\Delta {W}_{1}+\Delta {W}_{2}+\Delta {W}_{3}</math></center> | ||
| + | Tehát minden felvett hő munkavégzésre fordítódott. | ||
| + | <center><math>\begin{array}{ccc}\Delta {W}_{1}& =& {p}_{1}\left({V}_{2}-{V}_{1}\right)\\ | ||
| + | \Delta {W}_{2}& =& 0\\ | ||
| + | \Delta {W}_{3}& =& \underset{3}{\int }p\mathit{dV}=nR{T}_{1}\underset{{V}_{2}}{\overset{{V}_{1}}{\int }}\frac{\mathit{dV}}{V}\end{array}\rbrace \oint \delta Q=\oint {\mathit{dW}}_{\mathit{g\acute{a}z}}={p}_{1}\left({V}_{2}-{V}_{1}\right)+{p}_{1}{V}_{1}\ln \left(\frac{{V}_{1}}{{V}_{2}}\right)</math></center> | ||
| + | --> | ||
</wlatex> | </wlatex> | ||
</noinclude> | </noinclude> | ||
A lap 2013. április 8., 17:26-kori változata
| Navigáció Pt·1·2·3 |
|---|
| Kísérleti fizika 3. gyakorlat |
| Gyakorlatok listája: |
| Termodinamika - Fajhő, Körfolyamatok |
| Feladatok listája: |
| © 2012-2013 BME-TTK, TÁMOP4.1.2.A/1-11/0064 |
Feladat
-
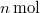 ,
, 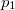 nyomású kétatomos ideális gázt
nyomású kétatomos ideális gázt 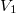 térfogatról állandó nyomáson
térfogatról állandó nyomáson 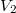 térfogatúra nyomunk össze (az ábrán 1-es út). Ezen az állandó térfogaton eredeti hőmérsékletére melegítjük (2-es út), majd izotermiksan a kiinduló térfogatára tágítjuk (3-as út).
térfogatúra nyomunk össze (az ábrán 1-es út). Ezen az állandó térfogaton eredeti hőmérsékletére melegítjük (2-es út), majd izotermiksan a kiinduló térfogatára tágítjuk (3-as út).
- a) Mennyivel változott a gáz belső energiája az 1-es úton?
- b) Mennyivel hőt kellet közölnünk a gázzal a 2-es úton?
- c) Mekkora a gáz által végzett munka és a gáz által felvett hő a teljes körfolyamatban?
Megoldás
A kétatomos ideális gázt 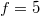 szabadsági fok és
szabadsági fok és 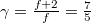 fajhőviszony jellemzi. Az egyes utakat
fajhőviszony jellemzi. Az egyes utakat 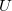 ,
, 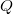 és
és 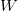 esetében alsó indexben jelöljük.
esetében alsó indexben jelöljük.
- a) Az idális gáz belső energiája kifejezhető a hőmérséklettel, amit pedig az állapotegyenlet segítségével tudunk a megadott adatokra visszavezetni:
![\[\Delta U_1=\frac{f}{2}nR\left(T_2-T_1\right)=\frac{f}{2}p_1\left(V_2-V_1\right).\]](/images/math/6/1/b/61b1644002315380656fd7c59581cb5a.png)
- b) Izochor átalakulás során nincs térfogati munka, azaz az I. főtétel
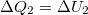 alakot ölti. Mivel a kezdeti hőmérsékletre térünk vissza
alakot ölti. Mivel a kezdeti hőmérsékletre térünk vissza 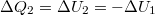 .
.
- c)