„Termodinamika példák - Ideális gáz egy körfolyamata izotermával” változatai közötti eltérés
A Fizipedia wikiből
a (→Feladat) |
|||
| 16. sor: | 16. sor: | ||
<wlatex>A kétatomos ideális gázt $f=5$ szabadsági fok és $\gamma=\frac{f+2}{f}=\frac{7}{5}$ fajhőviszony jellemzi. Az egyes utakat $U$, $Q$ és $W$ esetében alsó indexben jelöljük. | <wlatex>A kétatomos ideális gázt $f=5$ szabadsági fok és $\gamma=\frac{f+2}{f}=\frac{7}{5}$ fajhőviszony jellemzi. Az egyes utakat $U$, $Q$ és $W$ esetében alsó indexben jelöljük. | ||
* a) Az idális gáz belső energiája kifejezhető a hőmérséklettel, amit pedig az állapotegyenlet segítségével tudunk a megadott adatokra visszavezetni: <!-- | * a) Az idális gáz belső energiája kifejezhető a hőmérséklettel, amit pedig az állapotegyenlet segítségével tudunk a megadott adatokra visszavezetni: <!-- | ||
| − | --> $$\Delta U_1=\frac{f}{2}nR\left(T_2-T_1\right)=\frac{f}{2}p_1\left(V_2-V_1\right).$$ | + | --> $$\Delta U_1=\frac{f}{2}nR\left(T_2-T_1\right)=\frac{f}{2}p_1\left(V_2-V_1\right)=p_1\frac{V_2-V_1}{\gamma-1}.$$ |
* b) Izochor átalakulás során nincs térfogati munka, azaz az I. főtétel $\Delta Q_2 = \Delta U_2$ alakot ölti. Mivel a kezdeti hőmérsékletre térünk vissza $\Delta Q_2 = \Delta U_2 = -\Delta U_1$. | * b) Izochor átalakulás során nincs térfogati munka, azaz az I. főtétel $\Delta Q_2 = \Delta U_2$ alakot ölti. Mivel a kezdeti hőmérsékletre térünk vissza $\Delta Q_2 = \Delta U_2 = -\Delta U_1$. | ||
| − | * c) | + | * c) Körfolyamat során a rendszer eredeti állapotába kerül vissza, $\Delta U = \oint \delta U=0$, ezért az első főtétel értelmében $$\oint \delta Q = \oint \delta W =\Delta W_1+\Delta W_2+\Delta W_3$$ a három szakaszból számolható, minden felvett hő munkavégzésre fordítódik. Az egyes szakaszok: |
| − | + | * $\Delta W_1 = p_1\left(V_2-V_1\right)$, hiszen téglalap területét integráljuk; | |
| − | + | * $\Delta W_2 = 0$, hiszen nincs térfogatváltozás; | |
| − | + | * $\Delta W_3 = \int_3 p \mathrm{d}V = nR T_1 \int_{V_2}^{V_1} \frac{\mathrm{d}V}{V} = p_1 V_1 \ln (\frac{V_1}{V_2})$. | |
| − | + | Ezzel $$\Delta Q = \Delta W = p(V_2-V_1)+p_1V_1\ln\left(\frac{V_1}{V_2}\right).$$ | |
| − | \Delta | + | |
| − | \Delta | + | |
| − | + | ||
</wlatex> | </wlatex> | ||
</noinclude> | </noinclude> | ||
A lap 2013. április 12., 16:07-kori változata
| Navigáció Pt·1·2·3 |
|---|
| Kísérleti fizika 3. gyakorlat |
| Gyakorlatok listája: |
| Termodinamika - Fajhő, Körfolyamatok |
| Feladatok listája: |
| © 2012-2013 BME-TTK, TÁMOP4.1.2.A/1-11/0064 |
Feladat
-
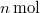 ,
, 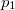 nyomású kétatomos ideális gázt
nyomású kétatomos ideális gázt 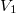 térfogatról állandó nyomáson
térfogatról állandó nyomáson 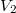 térfogatúra nyomunk össze (az ábrán 1-es út). Ezen az állandó térfogaton eredeti hőmérsékletére melegítjük (2-es út), majd izotermiksan a kiinduló térfogatára tágítjuk (3-as út).
térfogatúra nyomunk össze (az ábrán 1-es út). Ezen az állandó térfogaton eredeti hőmérsékletére melegítjük (2-es út), majd izotermiksan a kiinduló térfogatára tágítjuk (3-as út).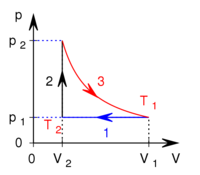
- a) Mennyivel változott a gáz belső energiája az 1-es úton?
- b) Mennyivel hőt kellet közölnünk a gázzal a 2-es úton?
- c) Mekkora a gáz által végzett munka és a gáz által felvett hő a teljes körfolyamatban?
Megoldás
A kétatomos ideális gázt 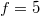 szabadsági fok és
szabadsági fok és 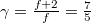 fajhőviszony jellemzi. Az egyes utakat
fajhőviszony jellemzi. Az egyes utakat  ,
, 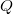 és
és 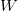 esetében alsó indexben jelöljük.
esetében alsó indexben jelöljük.
- a) Az idális gáz belső energiája kifejezhető a hőmérséklettel, amit pedig az állapotegyenlet segítségével tudunk a megadott adatokra visszavezetni:
![\[\Delta U_1=\frac{f}{2}nR\left(T_2-T_1\right)=\frac{f}{2}p_1\left(V_2-V_1\right)=p_1\frac{V_2-V_1}{\gamma-1}.\]](/images/math/1/0/a/10ad27fa61d1a6ef1bd0957f8ebe9d75.png)
- b) Izochor átalakulás során nincs térfogati munka, azaz az I. főtétel
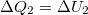 alakot ölti. Mivel a kezdeti hőmérsékletre térünk vissza
alakot ölti. Mivel a kezdeti hőmérsékletre térünk vissza 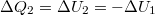 .
.
- c) Körfolyamat során a rendszer eredeti állapotába kerül vissza,
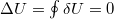 , ezért az első főtétel értelmében a három szakaszból számolható, minden felvett hő munkavégzésre fordítódik. Az egyes szakaszok:
, ezért az első főtétel értelmében a három szakaszból számolható, minden felvett hő munkavégzésre fordítódik. Az egyes szakaszok:![\[\oint \delta Q = \oint \delta W =\Delta W_1+\Delta W_2+\Delta W_3\]](/images/math/9/d/4/9d4b45bb82a829818f2be0db074bfed5.png)
-
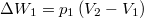 , hiszen téglalap területét integráljuk;
, hiszen téglalap területét integráljuk;
-
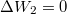 , hiszen nincs térfogatváltozás;
, hiszen nincs térfogatváltozás;
-
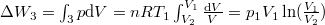 .
.
![\[\Delta Q = \Delta W = p(V_2-V_1)+p_1V_1\ln\left(\frac{V_1}{V_2}\right).\]](/images/math/8/6/0/860eab0c8097201b331e86834ecab3de.png)