„Termodinamika példák - Ideális gáz egy körfolyamata izotermával” változatai közötti eltérés
A Fizipedia wikiből
a (Szöveg koherenssé tétele) |
|||
| (egy szerkesztő egy közbeeső változata nincs mutatva) | |||
| 8. sor: | 8. sor: | ||
}} | }} | ||
== Feladat == | == Feladat == | ||
| − | </noinclude><wlatex># $n\,\mathrm{mol}$, $p_1$ nyomású kétatomos ideális gázt $V_1$ térfogatról állandó nyomáson $V_2$ térfogatúra nyomunk össze (az ábrán 1-es út). Ezen az állandó térfogaton eredeti hőmérsékletére melegítjük (2-es út), majd | + | </noinclude><wlatex># $n\,\mathrm{mol}$, $p_1$ nyomású kétatomos ideális gázt $V_1$ térfogatról állandó nyomáson $V_2$ térfogatúra nyomunk össze (az ábrán 1-es út). Ezen az állandó térfogaton eredeti hőmérsékletére melegítjük (2-es út), majd izotermikusan a kiinduló térfogatára tágítjuk (3-as út).<br />[[Fájl:Körfolyamat izotermával.svg|200px]]</wlatex> |
| − | #* a) Mennyivel változott a gáz belső energiája az 1-es úton | + | #* a) <wlatex>Mennyivel változott a gáz belső energiája az 1-es úton?</wlatex><includeonly><wlatex>{{Végeredmény|content=$$\Delta U_1 = p_1 \frac{V_2-V_1}{\gamma-1}, \qquad \gamma=\frac75$$}}</wlatex></includeonly> |
| − | + | #* b) <wlatex>Mennyivel hőt kellet közölnünk a gázzal a 2-es úton?</wlatex><includeonly><wlatex>{{Végeredmény|content=$$\Delta Q_2=-\Delta U_1$$}}</wlatex></includeonly> | |
| − | + | #* c) <wlatex>Mekkora a gáz által végzett munka és a gáz által felvett hő a teljes körfolyamatban?</wlatex><includeonly><wlatex>{{Végeredmény|content=$$\Delta W = \Delta Q = p(V_2-V_1)+p_1V_1\ln\left(\frac{V_1}{V_2}\right)$$}}</wlatex></includeonly><noinclude> | |
== Megoldás == | == Megoldás == | ||
<wlatex>A kétatomos ideális gázt $f=5$ szabadsági fok és $\gamma=\frac{f+2}{f}=\frac{7}{5}$ fajhőviszony jellemzi. Az egyes utakat $U$, $Q$ és $W$ esetében alsó indexben jelöljük. | <wlatex>A kétatomos ideális gázt $f=5$ szabadsági fok és $\gamma=\frac{f+2}{f}=\frac{7}{5}$ fajhőviszony jellemzi. Az egyes utakat $U$, $Q$ és $W$ esetében alsó indexben jelöljük. | ||
| − | + | ||
| − | + | '''a)''' Az ideális gáz belső energiája kifejezhető a hőmérséklettel, amit pedig az állapotegyenlet segítségével tudunk a megadott adatokra visszavezetni: | |
| − | + | $$ \Delta U_1 = \frac{f}{2}nR\left(T_2-T_1\right) | |
| − | + | = \frac{f}{2} p_1\left(V_2-V_1\right) | |
| − | * $\Delta W_1 = p_1\left(V_2-V_1\right)$, hiszen | + | = p_1\frac{V_2-V_1}{\gamma-1}. $$ |
| + | |||
| + | '''b)''' Izochor átalakulás során nincs térfogati munka, az első főtétel $\Delta Q_2 = \Delta U_2$ alakot ölti. Mivel a kezdeti hőmérsékletre térünk vissza | ||
| + | $$ \Delta Q_2 = \Delta U_2 = -\Delta U_1. $$ | ||
| + | |||
| + | '''c)''' Körfolyamat során a rendszer a kiindulási állapotába tér vissza, $\Delta U = \oint \mathrm{d}U = 0$, ezért az első főtétel értelmében | ||
| + | $$ \oint \delta Q = \oint \delta W = \Delta W_1+\Delta W_2+\Delta W_3 $$ | ||
| + | a három szakaszból számolható, minden felvett hő munkavégzésre fordítódik. Az egyes szakaszok: | ||
| + | * $\Delta W_1 = p_1\left(V_2-V_1\right)$, hiszen az integráljuk értéke a $p-V$ diagrambeli téglalap területe; | ||
* $\Delta W_2 = 0$, hiszen nincs térfogatváltozás; | * $\Delta W_2 = 0$, hiszen nincs térfogatváltozás; | ||
| − | * $\Delta W_3 = \int_3 p \mathrm{d}V = nR T_1 \int_{V_2}^{V_1} \frac{\mathrm{d}V}{V} = p_1 V_1 \ln (\frac{V_1}{V_2})$. | + | * $\Delta W_3 = \int_3 p \,\mathrm{d}V = nR T_1 \int_{V_2}^{V_1} \frac{\mathrm{d}V}{V} = p_1 V_1 \ln (\frac{V_1}{V_2})$. |
| − | + | Ezekkel $$\Delta Q = \Delta W = p(V_2-V_1)+p_1V_1\ln\left(\frac{V_1}{V_2}\right).$$ | |
</wlatex> | </wlatex> | ||
</noinclude> | </noinclude> | ||
A lap jelenlegi, 2013. május 4., 13:55-kori változata
| Navigáció Pt·1·2·3 |
|---|
| Kísérleti fizika 3. gyakorlat |
| Gyakorlatok listája: |
| Termodinamika - Fajhő, Körfolyamatok |
| Feladatok listája: |
| © 2012-2013 BME-TTK, TÁMOP4.1.2.A/1-11/0064 |
Feladat
-
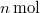 ,
, 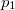 nyomású kétatomos ideális gázt
nyomású kétatomos ideális gázt 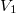 térfogatról állandó nyomáson
térfogatról állandó nyomáson 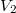 térfogatúra nyomunk össze (az ábrán 1-es út). Ezen az állandó térfogaton eredeti hőmérsékletére melegítjük (2-es út), majd izotermikusan a kiinduló térfogatára tágítjuk (3-as út).
térfogatúra nyomunk össze (az ábrán 1-es út). Ezen az állandó térfogaton eredeti hőmérsékletére melegítjük (2-es út), majd izotermikusan a kiinduló térfogatára tágítjuk (3-as út).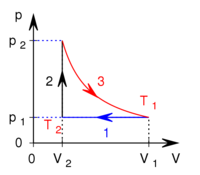
- a) Mennyivel változott a gáz belső energiája az 1-es úton?
- b) Mennyivel hőt kellet közölnünk a gázzal a 2-es úton?
- c) Mekkora a gáz által végzett munka és a gáz által felvett hő a teljes körfolyamatban?
Megoldás
A kétatomos ideális gázt 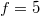 szabadsági fok és
szabadsági fok és 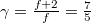 fajhőviszony jellemzi. Az egyes utakat
fajhőviszony jellemzi. Az egyes utakat  ,
, 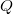 és
és 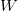 esetében alsó indexben jelöljük.
esetében alsó indexben jelöljük.
a) Az ideális gáz belső energiája kifejezhető a hőmérséklettel, amit pedig az állapotegyenlet segítségével tudunk a megadott adatokra visszavezetni:
![\[ \Delta U_1 = \frac{f}{2}nR\left(T_2-T_1\right) = \frac{f}{2} p_1\left(V_2-V_1\right) = p_1\frac{V_2-V_1}{\gamma-1}. \]](/images/math/e/a/4/ea40d5dd73674a88f012c599218d92f1.png)
b) Izochor átalakulás során nincs térfogati munka, az első főtétel 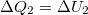 alakot ölti. Mivel a kezdeti hőmérsékletre térünk vissza
alakot ölti. Mivel a kezdeti hőmérsékletre térünk vissza
![\[ \Delta Q_2 = \Delta U_2 = -\Delta U_1. \]](/images/math/6/7/3/6730e1c3dc7b318682c5a6ac8de4fa84.png)
c) Körfolyamat során a rendszer a kiindulási állapotába tér vissza, 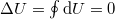 , ezért az első főtétel értelmében
, ezért az első főtétel értelmében
![\[ \oint \delta Q = \oint \delta W = \Delta W_1+\Delta W_2+\Delta W_3 \]](/images/math/9/6/f/96f2a17d8b64d6e75b03ea1c41665474.png)
a három szakaszból számolható, minden felvett hő munkavégzésre fordítódik. Az egyes szakaszok:
-
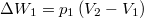 , hiszen az integráljuk értéke a
, hiszen az integráljuk értéke a 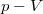 diagrambeli téglalap területe;
diagrambeli téglalap területe;
-
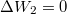 , hiszen nincs térfogatváltozás;
, hiszen nincs térfogatváltozás;
-
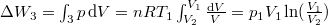 .
.
![\[\Delta Q = \Delta W = p(V_2-V_1)+p_1V_1\ln\left(\frac{V_1}{V_2}\right).\]](/images/math/8/6/0/860eab0c8097201b331e86834ecab3de.png)