„Termodinamika példák - A termodinamika differenciális összefüggései” változatai közötti eltérés
a |
(Elnevezések helyesen) |
||
| 25. sor: | 25. sor: | ||
A termodinamikai potenciálokon hajtsuk végre a [http://en.wikipedia.org/wiki/Legendre_transformation Legendre-transzformációt], ezt az alakot vessük össze a potenciál teljes differenciáljával: | A termodinamikai potenciálokon hajtsuk végre a [http://en.wikipedia.org/wiki/Legendre_transformation Legendre-transzformációt], ezt az alakot vessük össze a potenciál teljes differenciáljával: | ||
| − | === | + | === ''Helmholtz''-féle szabadenergia === |
| + | (''Régiesen exergiának is nevezik. Elterjedt ekvivalens jelölése $F(T,V)\equiv A(T,V)$, ami főleg külföldi szakirodalomban jelenik meg.'') | ||
$$ \boxed{F(T,V)=U-TS} $$ | $$ \boxed{F(T,V)=U-TS} $$ | ||
$$ \mathrm{d}F = \mathrm{d}U-S\,\mathrm{d}T-T\,\mathrm{d}S | $$ \mathrm{d}F = \mathrm{d}U-S\,\mathrm{d}T-T\,\mathrm{d}S | ||
| 33. sor: | 34. sor: | ||
| − | === '' | + | === Entalpia === |
| + | (''Ezt a függvényt ''Gibbs'' alkotta meg, de az elnevezése későbbről származik.'') | ||
$$ \boxed{H(S,p)=U+pV} $$ | $$ \boxed{H(S,p)=U+pV} $$ | ||
$$ \mathrm{d}H = \mathrm{d}U+V\,\mathrm{d}p+p\,\mathrm{d}V | $$ \mathrm{d}H = \mathrm{d}U+V\,\mathrm{d}p+p\,\mathrm{d}V | ||
| 41. sor: | 43. sor: | ||
| − | === ''Gibbs''-féle | + | === Szabadentalpia === |
| + | (''Szokás még ''Gibbs''-féle szabadenergiának is nevezni.'') | ||
$$ \boxed{G(T,p)=H-TS=U+pV-TS} $$ | $$ \boxed{G(T,p)=H-TS=U+pV-TS} $$ | ||
$$ \mathrm{d}G = \mathrm{d}U+V\,\mathrm{d}p+p\,\mathrm{d}V-S\,\mathrm{d}T-T\,\mathrm{d}S | $$ \mathrm{d}G = \mathrm{d}U+V\,\mathrm{d}p+p\,\mathrm{d}V-S\,\mathrm{d}T-T\,\mathrm{d}S | ||
A lap 2013. május 24., 19:36-kori változata
| [rejt] Navigáció Pt·1·2·3 |
|---|
| Kísérleti fizika 3. gyakorlat |
| Gyakorlatok listája: |
| Homogén rendszerek |
| Feladatok listája: |
| © 2012-2013 BME-TTK, TÁMOP4.1.2.A/1-11/0064 |
Feladat
- Bizonyítsuk be a
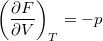 ,
, 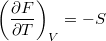 ,
, 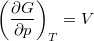 és
és 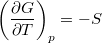 összefüggéseket!
összefüggéseket!
Megoldás
Számításainkat nem csak a feladatban előírt, hanem minden termodinamikai potenciálra elvégezzük. Amikor a kémiai potenciálok az alább megjelölt természetes változóikkal függvényeként vannak kifejezve, a termodinamika fundamentális függvényeinek is szokás őket nevezni.
Belső energia
(Megjegyezzük, hogy a 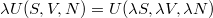 Euler-egyenlet megoldásaként
Euler-egyenlet megoldásaként 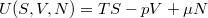 expliciten felírható, de erre a függvényalakra az alábbi tárgyalásban nincs szükség.)
expliciten felírható, de erre a függvényalakra az alábbi tárgyalásban nincs szükség.)
![\[ \boxed{U(S,V,N)} \]](/images/math/5/1/b/51be7d7fc7f5ccc2202ab6110ce5715f.png)
![\[ \mathrm{d}U = T\,\mathrm{d}S-p\,\mathrm{d}V+\mu\,\mathrm{d}N\]](/images/math/7/6/e/76e6aeb73b9e5da34b27ae8b7daece42.png)
![\[ \left(\frac{\partial U}{\partial S}\right)_{V,N} = T, \qquad \left(\frac{\partial U}{\partial V}\right)_{S,N} = -p, \]](/images/math/5/b/4/5b4dcd237a3399e88f6d48bb6e38e2ac.png)
![\[ \left(\frac{\partial U}{\partial N}\right)_{V,S} = \mu. \]](/images/math/9/8/5/985c9d49cca062c3b5806ec376c411c9.png)
A továbbiakban a kémiai potenciáltól és részecskeszámtól való függést nem írjuk ki.
A termodinamikai potenciálokon hajtsuk végre a Legendre-transzformációt, ezt az alakot vessük össze a potenciál teljes differenciáljával:
Helmholtz-féle szabadenergia
(Régiesen exergiának is nevezik. Elterjedt ekvivalens jelölése 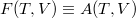 , ami főleg külföldi szakirodalomban jelenik meg.)
, ami főleg külföldi szakirodalomban jelenik meg.)
![\[ \boxed{F(T,V)=U-TS} \]](/images/math/c/2/2/c228f071e06169fba2eac546a8f2869d.png)
![\[ \mathrm{d}F = \mathrm{d}U-S\,\mathrm{d}T-T\,\mathrm{d}S = -S\,\mathrm{d}T - p\,\mathrm{d}V = \left(\frac{\partial F}{\partial T}\right)_V \mathrm{d}T + \left(\frac{\partial F}{\partial V}\right)_T \mathrm{d}V, \]](/images/math/1/e/d/1ed15bd6f02d7547eb2163b410dbfe52.png)
![\[ \left(\frac{\partial F}{\partial T}\right)_V = -S, \qquad \left(\frac{\partial F}{\partial V}\right)_T = -p. \]](/images/math/0/7/0/0706881a87c9005b38dded32357e5366.png)
Entalpia
(Ezt a függvényt Gibbs alkotta meg, de az elnevezése későbbről származik.)
![\[ \boxed{H(S,p)=U+pV} \]](/images/math/8/8/4/884bd8120a9a539d4cac9512260e2cac.png)
![\[ \mathrm{d}H = \mathrm{d}U+V\,\mathrm{d}p+p\,\mathrm{d}V = T\,\mathrm{d}S + V\,\mathrm{d}p = \left(\frac{\partial H}{\partial S}\right)_p \mathrm{d}S + \left(\frac{\partial H}{\partial p}\right)_S \mathrm{d}p, \]](/images/math/9/6/c/96cac60f2233c0be74a4e76235101d49.png)
![\[ \left(\frac{\partial H}{\partial S}\right)_p = T, \qquad \left(\frac{\partial H}{\partial p}\right)_S = V. \]](/images/math/d/9/5/d9531493a9cdf34987675483d1bf16fc.png)
Szabadentalpia
(Szokás még Gibbs-féle szabadenergiának is nevezni.)
![\[ \boxed{G(T,p)=H-TS=U+pV-TS} \]](/images/math/9/c/6/9c61867b109200786ddd712d36b3b61d.png)
![\[ \mathrm{d}G = \mathrm{d}U+V\,\mathrm{d}p+p\,\mathrm{d}V-S\,\mathrm{d}T-T\,\mathrm{d}S = -S\,\mathrm{d}T + V\,\mathrm{d}p = \left(\frac{\partial G}{\partial T}\right)_p \mathrm{d}T + \left(\frac{\partial G}{\partial p}\right)_T \mathrm{d}p, \]](/images/math/b/a/8/ba86d2b8ebddb79750447e9efe79b72c.png)
![\[ \left(\frac{\partial G}{\partial T}\right)_p=-S, \qquad \left(\frac{\partial G}{\partial p}\right)_T=V. \]](/images/math/7/8/d/78d7b1a320ec58244ccdb8fdc0fcc62b.png)
Megjegyezzük, hogy a szabadentalpia szoros kapcsolatban áll a kémiai potenciállal: 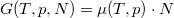 és
és 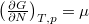 .
.