„Termodinamika - Homogén rendszerek” változatai közötti eltérés
A Fizipedia wikiből
a |
|||
| (egy szerkesztő 2 közbeeső változata nincs mutatva) | |||
| 1. sor: | 1. sor: | ||
| + | <noinclude> | ||
[[Kategória:Kísérleti fizika 3. gyakorlat]] | [[Kategória:Kísérleti fizika 3. gyakorlat]] | ||
[[Kategória:Szerkesztő:Stippinger]] | [[Kategória:Szerkesztő:Stippinger]] | ||
| 5. sor: | 6. sor: | ||
| gyaksorszám = 5 | | gyaksorszám = 5 | ||
| témakör = Termodinamika - Homogén rendszerek | | témakör = Termodinamika - Homogén rendszerek | ||
| + | | fejezetlap = true | ||
}} | }} | ||
== Mérhető mennyiségek == | == Mérhető mennyiségek == | ||
<wlatex>{| style="margin-left: auto; margin-right: auto;" | <wlatex>{| style="margin-left: auto; margin-right: auto;" | ||
| align="right" | $\displaystyle C_V$ || = || $\displaystyle \left( \frac{\partial U}{\partial T} \right)_V$ | | align="right" | $\displaystyle C_V$ || = || $\displaystyle \left( \frac{\partial U}{\partial T} \right)_V$ | ||
| − | | állandó térfogaton mért | + | | állandó térfogaton mért hőkapacitás* |
|- | |- | ||
| align="right" | $\displaystyle C_p$ || = || $\displaystyle \left( \frac{\partial H}{\partial T} \right)_p$ | | align="right" | $\displaystyle C_p$ || = || $\displaystyle \left( \frac{\partial H}{\partial T} \right)_p$ | ||
| − | | állandó nyomáson mért | + | | állandó nyomáson mért hőkapacitás* |
|- | |- | ||
| align="right" | $\displaystyle \beta_p$ || = || $\displaystyle \frac{1}{V} \left( \frac{\partial V}{\partial T} \right)_p$ | | align="right" | $\displaystyle \beta_p$ || = || $\displaystyle \frac{1}{V} \left( \frac{\partial V}{\partial T} \right)_p$ | ||
| 23. sor: | 25. sor: | ||
| adiabatikus kompresszibilitás | | adiabatikus kompresszibilitás | ||
|} | |} | ||
| + | <nowiki>*</nowiki> ha egységnyi tömegre illetve anyagmennyiségre vonatkoztatjuk, akkor rendre fajhőnek illetve mólhőnek nevezzük. | ||
</wlatex> | </wlatex> | ||
== Feladatok == | == Feladatok == | ||
| + | </noinclude> | ||
{{:Termodinamika példák - A termodinamika differenciális összefüggései}}{{Megoldás|link=Termodinamika példák - A termodinamika differenciális összefüggései}} | {{:Termodinamika példák - A termodinamika differenciális összefüggései}}{{Megoldás|link=Termodinamika példák - A termodinamika differenciális összefüggései}} | ||
{{:Termodinamika példák - Maxwell-relációk}}{{Megoldás|link=Termodinamika példák - Maxwell-relációk}} | {{:Termodinamika példák - Maxwell-relációk}}{{Megoldás|link=Termodinamika példák - Maxwell-relációk}} | ||
A lap jelenlegi, 2013. május 4., 15:00-kori változata
| Navigáció Pt·1·2·3 |
|---|
| Kísérleti fizika 3. gyakorlat |
| Gyakorlatok listája: |
| Termodinamika - Homogén rendszerek |
| Feladatok listája: |
| © 2012-2013 BME-TTK, TÁMOP4.1.2.A/1-11/0064 |
Mérhető mennyiségek
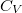 |
= | 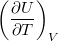
|
állandó térfogaton mért hőkapacitás* |
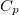 |
= | 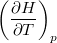
|
állandó nyomáson mért hőkapacitás* |
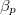 |
= | 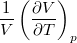
|
izobár hőtágulási együttható |
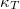 |
= | 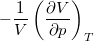
|
izoterm kompresszibilitás |
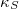 |
= | 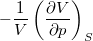
|
adiabatikus kompresszibilitás |
* ha egységnyi tömegre illetve anyagmennyiségre vonatkoztatjuk, akkor rendre fajhőnek illetve mólhőnek nevezzük.
Feladatok
- Bizonyítsuk be a
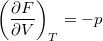 ,
, 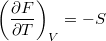 ,
, 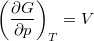 és
és 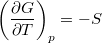 összefüggéseket!
összefüggéseket!
- Bizonyítsuk be a
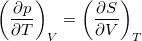 Maxwell-összefüggést!
Maxwell-összefüggést!
- Állandó anyagmennyiségű homogén rendszerben termikus és mechanikai kölcsönhatás esetén fennáll a
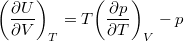 egyenlet. A fenti egyenlet levezetésének mintájára bizonyítsuk be, hogy ha a termikus kölcsönhatás mellett tetszőleges –
egyenlet. A fenti egyenlet levezetésének mintájára bizonyítsuk be, hogy ha a termikus kölcsönhatás mellett tetszőleges – 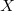 intenzív- és
intenzív- és 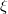 extenzív mennyiségpárral jellemzett – kölcsönhatás lép fel, akkor a fenti egyenlet érvényes marad, ha végrehajtjuk a
extenzív mennyiségpárral jellemzett – kölcsönhatás lép fel, akkor a fenti egyenlet érvényes marad, ha végrehajtjuk a 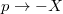 és a
és a 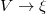 változócserét!
változócserét!
- Fejezzük ki mérhető mennyiségekkel (hőtágulási együttható, kompresszibilitás, mólhő) egy rendszer
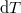 hőmérséklet-változását, ha térfogata adiabatikus, kvázisztatikus folyamat során
hőmérséklet-változását, ha térfogata adiabatikus, kvázisztatikus folyamat során 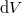 -vel megváltozik! Mutassuk meg, hogy
-vel megváltozik! Mutassuk meg, hogy 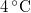 alatt a víz adiabatikus, kvázisztatikus összenyomáskor lehűl!ÚtmutatásÍrjuk fel az első főtételt, írjuk be az
alatt a víz adiabatikus, kvázisztatikus összenyomáskor lehűl!ÚtmutatásÍrjuk fel az első főtételt, írjuk be az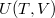 függvény teljes differenciálját, alkalmazzuk a belső energia térfogatfüggésére érvényes összefüggést, és a nyomás hőmérsékletfüggéséről szóló feladat eredményét! A víz hőtágulási együtthatója
függvény teljes differenciálját, alkalmazzuk a belső energia térfogatfüggésére érvényes összefüggést, és a nyomás hőmérsékletfüggéséről szóló feladat eredményét! A víz hőtágulási együtthatója 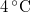 alatt negatív.
alatt negatív.
- Feltételezve, hogy
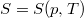 , mutassuk ki, hogy
, mutassuk ki, hogy 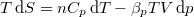 , ahol
, ahol 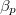 az izobár hőtágulási együttható.ÚtmutatásÍrjuk fel
az izobár hőtágulási együttható.ÚtmutatásÍrjuk fel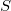 teljes differenciálját, használjuk a
teljes differenciálját, használjuk a 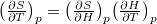 matematikai összefüggést, a termodinamika két differenciális összefüggését és a
matematikai összefüggést, a termodinamika két differenciális összefüggését és a 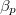 definícióját.
definícióját.
- Az első főtétel és a termodinamika differenciálegyenletei felhasználásával mutassuk meg, hogy ha ismerjük egy állandó anyagmennyiségű rendszer belső energiáját a térfogat és az entrópia függvényeként (vagyis az
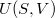 függvényt), akkor a rendszer bármely állapotjelzője (nyomás, hőmérséklet, entalpia, stb.) megadható
függvényt), akkor a rendszer bármely állapotjelzője (nyomás, hőmérséklet, entalpia, stb.) megadható 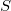 és
és 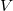 függvényeként!
függvényeként!
- Mennyivel változik egy
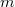 tömegű,
tömegű,  hőmérsékletű,
hőmérsékletű, 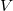 térfogatú rendszer entrópiája, ha térfogata állandó nyomáson
térfogatú rendszer entrópiája, ha térfogata állandó nyomáson 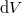 értékkel megnő? Az állandó nyomáson mért
értékkel megnő? Az állandó nyomáson mért 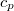 fajhőt és a
fajhőt és a 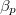 hőtágulási együtthatót ismertnek tekintjük.ÚtmutatásÍrjuk fel az
hőtágulási együtthatót ismertnek tekintjük.ÚtmutatásÍrjuk fel az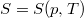 függvény teljes differenciálját állandó nyomáson, és alkalmazzuk
függvény teljes differenciálját állandó nyomáson, és alkalmazzuk 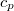 és
és 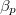 definícióját! Végeredmény
definícióját! Végeredmény![\[\mathrm{d}S=\frac{m c_p}{TV\beta_p}\,\mathrm{d}V\]](/images/math/8/9/1/8913482ffd0e5fd05a97ff4d3c990a0a.png)
- Egy rendszer állapotegyenlete
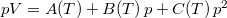 , ahol a hőmérsékletfüggő együtthatók kísérletekből ismertek. Mennyit változik a rendszer szabad entalpiája és entrópiája, ha a nyomást rögzített
, ahol a hőmérsékletfüggő együtthatók kísérletekből ismertek. Mennyit változik a rendszer szabad entalpiája és entrópiája, ha a nyomást rögzített  hőmérsékleten
hőmérsékleten 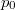 -ról
-ról 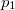 -re változtatjuk?ÚtmutatásHasználjuk ki a
-re változtatjuk?ÚtmutatásHasználjuk ki a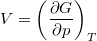 és az
és az 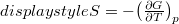 összefüggéseket! Végeredményés
összefüggéseket! Végeredményés![\[\Delta G=A\ln\left(\frac{p_1}{p_0}\right)+B\left(p_1-p_0\right)+C\frac{p_1^2-p_0^2}{2}\]](/images/math/6/0/4/604b4690f62d9f0616982b2cd9d8dfe5.png) ahol a vessző a hőmérséklet szerinti deriváltat jelenti.
ahol a vessző a hőmérséklet szerinti deriváltat jelenti.![\[\Delta S=A'\ln\left(\frac{p_1}{p_0}\right)+B'\left(p_1-p_0\right)+C'\frac{p_1^2-p_0^2}{2},\]](/images/math/9/4/d/94dc473377e76fb6ed5fbb18beabd15f.png)
- Egy gumiszalag állapotegyenlete
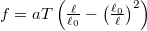 alakba írható, ahol
alakba írható, ahol 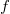 a szalagban fellépő húzóerő nagysága,
a szalagban fellépő húzóerő nagysága, 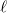 a szalag hossza,
a szalag hossza,  a hőmérséklet,
a hőmérséklet, 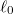 a szalag erőmentes hossza,
a szalag erőmentes hossza,  pozitív állandó.
pozitív állandó.
- a) Mutassuk ki, hogy a belső energia nem függ a szalag hosszától!ÚtmutatásA belső energia térfogatfüggésére kapott általános összefüggés átírható a vizsgált esetre a
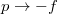 és
és 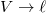 helyettesítéssel.
helyettesítéssel. - b) Írjuk fel a termodinamika fundamentális egyenletét, továbbá a szabad energia és a szabad entalpia megváltozását a gumiszalagra!ÚtmutatásAlkalmazzuk az a) pontban leírt fenti változócseréket!Végeredmény
![\[\mathrm{d}U=T\mathrm{d}S+f\mathrm{d}\ell\]](/images/math/7/f/5/7f5decf22c82e848373c1a93e96bafaf.png)
- c) Mekkora munkát végzünk, és mennyi a gumiszalag által leadott hő, ha a szalag hosszát izotermikus, reverzíbilis folyamatban
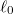 -ról
-ról 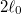 -ra növeljük.ÚtmutatásHasználjuk az I. főtételt, és vegyük figyelembe az a) részfeladat eredményét!Végeredmény
-ra növeljük.ÚtmutatásHasználjuk az I. főtételt, és vegyük figyelembe az a) részfeladat eredményét!Végeredmény![\[W=Q_\text{le}=\int_{\ell_0}^{2\ell_0}f\mathrm{d}\ell\]](/images/math/a/9/2/a92623436a83ffbf664f8f1a1b3458ef.png)
- d) Igazoljuk, hogy a gumiszalag hőmérséklete megnő, ha adiabatikusan megnyújtjuk!ÚtmutatásHasonlítsuk össze a fundamentális egyenletet és az
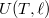 függvény teljes differenciálját, és vegyük figyelembe az (a) részfeladat eredményét! Végeredményahol
függvény teljes differenciálját, és vegyük figyelembe az (a) részfeladat eredményét! Végeredményahol![\[\left(\frac{\partial T}{\partial \ell}\right)_S=\frac{f}{C_\ell}>0,\]](/images/math/4/8/f/48fb10b34970193d78d5a4a66ee9c31c.png)
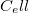 az állandó hossznál mért hőkapacitás.
az állandó hossznál mért hőkapacitás.
- a) Mutassuk ki, hogy a belső energia nem függ a szalag hosszától!
- Mennyi hő szabadul fel az
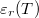 dielektromos állandójú dielektrikum polarizációjakor, ha a külső elektromos tér nagyságát állandó hőmérsékleten, kvázi-stacionáriusan növeljük nulláról egy nem túl nagy
dielektromos állandójú dielektrikum polarizációjakor, ha a külső elektromos tér nagyságát állandó hőmérsékleten, kvázi-stacionáriusan növeljük nulláról egy nem túl nagy 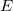 értékre? A térfogatváltozás elhanyagolható.ÚtmutatásHasználjuk az I. főtétel
értékre? A térfogatváltozás elhanyagolható.ÚtmutatásHasználjuk az I. főtétel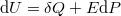 alakját, az
alakját, az 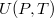 függvény teljes differenciálját, és azt, hogy a belső energia térfogatfüggésére kapott általános összefüggés átírható erre az esetre is a dielektrikum teljes dipólusmomentuma (
függvény teljes differenciálját, és azt, hogy a belső energia térfogatfüggésére kapott általános összefüggés átírható erre az esetre is a dielektrikum teljes dipólusmomentuma (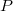 ) segítségével a
) segítségével a  és
és  helyettesítéssel:
helyettesítéssel: 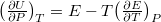 . Alkalmazzuk még a
. Alkalmazzuk még a 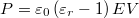 összefüggést is! Végeredmény
összefüggést is! Végeredmény![\[Q=-\frac12T\varepsilon_0V\frac{\mathrm{d}\varepsilon_r(T)}{\mathrm{d}T}E^2\]](/images/math/7/4/8/748a2556baf501bef94eaf7c54b03a77.png)