„Kvantummechanikai bevezető példák - Bohr-féle hidrogénmodell” változatai közötti eltérés
A Fizipedia wikiből
a |
|||
| 14. sor: | 14. sor: | ||
$$ L_n \equiv m_e v_n r_n = n\hbar. $$ | $$ L_n \equiv m_e v_n r_n = n\hbar. $$ | ||
A pályasugarakat és sebességeket a klasszikus képben végzet számításokból kapjuk: az atommag $F_C=\frac{1}{4\pi\varepsilon_0}{e^2}{r^2}$ Coulomb-vonzása az $F_{cp}=m_e a_{cp}$ centripetális erő, ami körpályán tartja az elektront: | A pályasugarakat és sebességeket a klasszikus képben végzet számításokból kapjuk: az atommag $F_C=\frac{1}{4\pi\varepsilon_0}{e^2}{r^2}$ Coulomb-vonzása az $F_{cp}=m_e a_{cp}$ centripetális erő, ami körpályán tartja az elektront: | ||
| − | $$ m_e \frac{ | + | $$ m_e \frac{v_n^2}{r_n} = \frac{1}{4\pi\varepsilon_0}\frac{e^2}{r_n^2} . $$ |
$r$-rel való egyszerűsítés után beírjuk a kvantumgfeltételből kapott $r_n = \frac{n\hbar}{m_e v_n}$ összefüggést, akkor a sebesség, és így a sugár lehetséges értékei rendre | $r$-rel való egyszerűsítés után beírjuk a kvantumgfeltételből kapott $r_n = \frac{n\hbar}{m_e v_n}$ összefüggést, akkor a sebesség, és így a sugár lehetséges értékei rendre | ||
$$ v_n = \frac{v_0}{n} = \alpha_f \frac{c}{n}, \qquad r_n = a_0 n^2 = \frac{n^2\hbar}{\alpha_f m_e c}, $$ | $$ v_n = \frac{v_0}{n} = \alpha_f \frac{c}{n}, \qquad r_n = a_0 n^2 = \frac{n^2\hbar}{\alpha_f m_e c}, $$ | ||
A lap 2013. április 23., 20:03-kori változata
| [rejt] Navigáció Pt·1·2·3 |
|---|
| Kísérleti fizika 3. gyakorlat |
| Gyakorlatok listája: |
| Kvantummechanikai bevezető |
| Feladatok listája: |
| © 2012-2013 BME-TTK, TÁMOP4.1.2.A/1-11/0064 |
Feladat
- Számítsa ki a hidrogénatom Bohr-féle modelljében a „körpályán” keringő elektron pályasugarát, sebességét, perdületét és energiáját!
Megoldás
A Bohr-féle hidrogénmodellben az elektron a rögzített atommag körül kering, impulzusmomentum a 3. posztulátum szerint kvantált, az 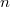 . pályán:
. pályán:
![\[ L_n \equiv m_e v_n r_n = n\hbar. \]](/images/math/5/c/0/5c02a06ab263c34d25406999d46b5959.png)
A pályasugarakat és sebességeket a klasszikus képben végzet számításokból kapjuk: az atommag 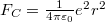 Coulomb-vonzása az
Coulomb-vonzása az 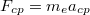 centripetális erő, ami körpályán tartja az elektront:
centripetális erő, ami körpályán tartja az elektront:
![\[ m_e \frac{v_n^2}{r_n} = \frac{1}{4\pi\varepsilon_0}\frac{e^2}{r_n^2} . \]](/images/math/f/b/5/fb5d4c35ef9b02a2e7c2ef1b85325b09.png)
 -rel való egyszerűsítés után beírjuk a kvantumgfeltételből kapott
-rel való egyszerűsítés után beírjuk a kvantumgfeltételből kapott 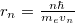 összefüggést, akkor a sebesség, és így a sugár lehetséges értékei rendre
összefüggést, akkor a sebesség, és így a sugár lehetséges értékei rendre
![\[ v_n = \frac{v_0}{n} = \alpha_f \frac{c}{n}, \qquad r_n = a_0 n^2 = \frac{n^2\hbar}{\alpha_f m_e c}, \]](/images/math/2/b/e/2be3cebe0f16758cbd9fc06ac6b68dac.png)
ahol a legnagyobb pályasebesség és a Bohr-sugár rendre
![\[ v_0 = \frac{e^2}{4\pi\varepsilon_0\hbar}, \qquad a_0 = \frac{\hbar^2 4 \pi \varepsilon_0}{m_e e^2} \]](/images/math/9/3/4/934fe4b6a09181e8ed24815e349f87e7.png)
![\[ v_0 \approx 2{,}187 \cdot 10^6\,\mathrm{\frac{m}{s}}, \qquad a_0 \approx 5{,}292 \cdot 10^{-11}\,\mathrm{m} \]](/images/math/d/5/3/d534b714fba4a72278281d49c55ee055.png)
valamint bevezettük a
![\[ \alpha_f = \frac{e^2}{4\pi \varepsilon_0\hbar c} \approx \frac{1}{137{,}036} \]](/images/math/f/b/a/fba47f5f54066c9141619cfc8c990bd1.png)
jelölést a finomszerkezeti állandóra.
A hidrogénatomban az elektron energiája
![\[ E_n = E_{\text{kin}\,n} + E_{\text{pot}\,n} = \frac12 m_e v_n^2 - \frac{1}{4\pi\varepsilon_0}\frac{e^2}{r^2}, \]](/images/math/1/e/1/1e17ccca0c803b90f8c942be9e8f140b.png)
az előző jelölésekkel
![\[ E_n = - \frac{m_e e^4}{2\hbar^2(4\pi\varepsilon_0)^2} \cdot \frac{1}{n^2} = -\frac12 m_e c^2 \alpha_f^2 \frac{1}{n^2} = -\frac{E_0}{n^2}, \]](/images/math/0/9/7/0973adbff9cdae97478e71035d9fb232.png)
ahol 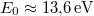 a hidrogén ionizációs energiája. A negatív előjel a kötött állapotra utal.
a hidrogén ionizációs energiája. A negatív előjel a kötött állapotra utal.