„Kísérleti fizika 3. gyakorlat: Teljes példasor” változatai közötti eltérés
A Fizipedia wikiből
a |
|||
| 8. sor: | 8. sor: | ||
== [[Termodinamika - Állapotváltozás, I. főtétel|Állapotváltozás, I. főtétel]] == | == [[Termodinamika - Állapotváltozás, I. főtétel|Állapotváltozás, I. főtétel]] == | ||
{{:Termodinamika - Állapotváltozás, I. főtétel}} | {{:Termodinamika - Állapotváltozás, I. főtétel}} | ||
| − | == [[Fajhő, Körfolyamatok| | + | == [[Termodinamika - Fajhő, Körfolyamatok|Fajhő, Körfolyamatok]] == |
{{:Termodinamika - Fajhő, Körfolyamatok}} | {{:Termodinamika - Fajhő, Körfolyamatok}} | ||
== [[Termodinamika - Entrópia, II. főtétel|Entrópia, II. főtétel]] == | == [[Termodinamika - Entrópia, II. főtétel|Entrópia, II. főtétel]] == | ||
A lap 2013. április 21., 19:20-kori változata
Az egyes feladatsorok a legfontosabb képletekkel kiegészítve egyenként is elérhetőek a címekre klikkelve.
Tartalomjegyzék[elrejtés] |
Kinetikus gázelmélet, transzportfolyamatok
- Fejezze ki az egyatomos ideális gáz nyomását a gáz
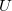 belső energiájával és
belső energiájával és 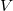 térfogatával!
térfogatával!
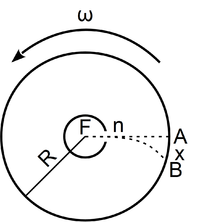
- Stern híres kísérletében, amellyel a Maxwell-eloszlás kísérleti igazolását adta,
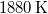 -es ezüstszálról távozó atomok sebességeloszlását mérte meg, az ábrán vázolt elrendezéssel. Az
-es ezüstszálról távozó atomok sebességeloszlását mérte meg, az ábrán vázolt elrendezéssel. Az 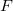 pontbeli tengelyen elhelyezkedő szálról távozó ezüstatomok az
pontbeli tengelyen elhelyezkedő szálról távozó ezüstatomok az 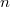 nyíláson át jutottak az
nyíláson át jutottak az 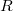 sugarú hengerfelületre. A berendezés
sugarú hengerfelületre. A berendezés  szögsebességgel forgott, aminek következtében a
szögsebességgel forgott, aminek következtében a  sebességű atom az
sebességű atom az 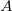 pont helyett
pont helyett 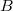 -ben csapódott le.
-ben csapódott le.
- a) Állapítsuk meg az
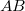 ív
ív  hosszát
hosszát 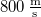 sebességű atomok esetén, ha a fordulatszám
sebességű atomok esetén, ha a fordulatszám 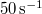 és
és 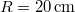 !
!
- b) Milyen sebességnél adják a legnagyobb rétegvastagságot a külső hengerfelületen lecsapódó ezüstatomok?
- a) Állapítsuk meg az
- Az
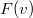 sebességeloszlási függvényből a
sebességeloszlási függvényből a 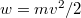 összefüggés felhasználásával vezessük le az
összefüggés felhasználásával vezessük le az 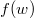 energia-eloszlási függvényt, ahol
energia-eloszlási függvényt, ahol 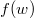 azt mutatja meg, hogy az összes molekula hányadrésze rendelkezik
azt mutatja meg, hogy az összes molekula hányadrésze rendelkezik 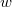 és
és 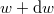 közötti mozgási energiával! Mekkora a legvalószínűbb
közötti mozgási energiával! Mekkora a legvalószínűbb 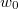 energia és mennyi az átlagos kinetikus energia?
energia és mennyi az átlagos kinetikus energia?
- Legfeljebb mekkora lehet az
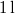 térfogatú, gömb alakú edényben lévő
térfogatú, gömb alakú edényben lévő 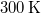 -es hidrogéngáz nyomása, hogy az átlagos szabad úthossz nagyobb legyen az edény átmérőjénél? A hidrogénmolekula átmérője
-es hidrogéngáz nyomása, hogy az átlagos szabad úthossz nagyobb legyen az edény átmérőjénél? A hidrogénmolekula átmérője 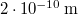 .
.
- Hogyan változik az ideális gáz
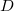 diffúziós állandója és
diffúziós állandója és 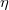 belső súrlódási együtthatója, ha a gáz térfogata
belső súrlódási együtthatója, ha a gáz térfogata 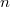 -szersére nő
-szersére nő
- a) állandó hőmérsékleten,
- b) állandó nyomáson?
-
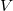 térfogatú, vékonyfalú tartályban ideális gáz van, az edényt légüres tér veszi körül. Feltesszük, hogy a gáz kiáramlása lassú, így a gáz egyensúlyi állapotát a folyamat nem zavarja, továbbá a lyuk mérete sokkal kisebb, mint a szabad úthossz, tehát a lyuk területére is érvényes az az összefüggés, hogy az edény falának időegység alatt nekiütköző molekulák száma
térfogatú, vékonyfalú tartályban ideális gáz van, az edényt légüres tér veszi körül. Feltesszük, hogy a gáz kiáramlása lassú, így a gáz egyensúlyi állapotát a folyamat nem zavarja, továbbá a lyuk mérete sokkal kisebb, mint a szabad úthossz, tehát a lyuk területére is érvényes az az összefüggés, hogy az edény falának időegység alatt nekiütköző molekulák száma 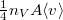 , ahol
, ahol 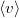 a molekulák átlagsebessége. A hőmérséklet mindvégig
a molekulák átlagsebessége. A hőmérséklet mindvégig  .
.
- a) Hogyan változik az idő függvényében az edényben lévő gáz
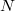 részecskeszáma, ha a tartály falán igen kicsi,
részecskeszáma, ha a tartály falán igen kicsi, 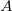 területű lyuk van?
területű lyuk van?
- b) Határozzuk meg azt az időtartamot, amely alatt a gáz nyomása felére csökken!
- a) Hogyan változik az idő függvényében az edényben lévő gáz
- Két azonos térfogatú tartály kapcsolódik egymáshoz, a szabad úthosszhoz képest kisméretű nyíláson keresztül. Az egyikben
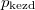 nyomású, a másikban kétszer akkora nyomású hidrogéngáz van. A gázok
nyomású, a másikban kétszer akkora nyomású hidrogéngáz van. A gázok  hőmérséklete azonos és időben állandó. A kinetikus gázelmélet segítségével mutassuk ki, hogy a két tartályban azonos
hőmérséklete azonos és időben állandó. A kinetikus gázelmélet segítségével mutassuk ki, hogy a két tartályban azonos 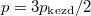 egyensúlyi nyomás alakul ki!
egyensúlyi nyomás alakul ki!
- Két azonos térfogatú tartály kapcsolódik egymáshoz, a szabad úthosszhoz képest kisméretű nyíláson keresztül. Az egyikben
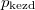 nyomású hidrogéngáz, a másikban kétszer akkora nyomású oxigéngáz van. A gázok
nyomású hidrogéngáz, a másikban kétszer akkora nyomású oxigéngáz van. A gázok  hőmérséklete azonos és időben állandó. A kinetikus gázelmélet segítségével mutassuk ki, hogy a két tartályban azonos
hőmérséklete azonos és időben állandó. A kinetikus gázelmélet segítségével mutassuk ki, hogy a két tartályban azonos 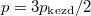 egyensúlyi nyomás alakul ki!
egyensúlyi nyomás alakul ki!
- Egy
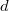 vastagságú, nagy felületű, homogén anyagréteg két ellentétes felületén a hőmérséklet állandó
vastagságú, nagy felületű, homogén anyagréteg két ellentétes felületén a hőmérséklet állandó 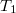 és
és 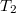 , az anyag hővezetési tényezője hőmérséklet- és helyfüggetlen. A hővezetés alapegyenlete segítségével mutassuk ki, hogy a rétegben a hőmérséklet lineárisan változik az egyik felülettől mért
, az anyag hővezetési tényezője hőmérséklet- és helyfüggetlen. A hővezetés alapegyenlete segítségével mutassuk ki, hogy a rétegben a hőmérséklet lineárisan változik az egyik felülettől mért  távolsággal, és írjuk fel a
távolsággal, és írjuk fel a 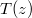 függvényt a megadott mennyiségekkel!
függvényt a megadott mennyiségekkel!
- Mennyi idő alatt képződik
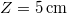 vastag jégréteg egy tó felszínén, ha a léghőmérséklet
vastag jégréteg egy tó felszínén, ha a léghőmérséklet 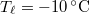 , a víz hőmérséklete a jégréteg alatt
, a víz hőmérséklete a jégréteg alatt 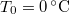 ? Tegyük fel, hogy a jégréteg felső felülete mindig azonos hőmérsékletű a levegővel, alső felülete pedig mindig
? Tegyük fel, hogy a jégréteg felső felülete mindig azonos hőmérsékletű a levegővel, alső felülete pedig mindig 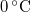 -os. A jég olvadáshője
-os. A jég olvadáshője 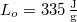 , hővezetési tényezője
, hővezetési tényezője 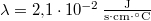 , sűrűsége pedig
, sűrűsége pedig 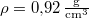 .
.
-
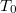 hőmérsékletű, igen nagy hőkapacitású folyadékba
hőmérsékletű, igen nagy hőkapacitású folyadékba 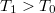 hőmérsékletű,
hőmérsékletű, 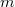 tömegű és
tömegű és  fajhőjű, abszolút jó hővezető testet helyezünk a
fajhőjű, abszolút jó hővezető testet helyezünk a 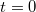 pillanatban. A test lehűlése a Newton-féle lehűlési törvény szerint zajlik (
pillanatban. A test lehűlése a Newton-féle lehűlési törvény szerint zajlik (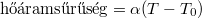 ), az
), az 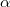 hőátadási tényező ismert, a test felületének nagysága
hőátadási tényező ismert, a test felületének nagysága 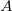 . Határozzuk meg a test hőmérsékletét
. Határozzuk meg a test hőmérsékletét 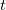 idő eltelte után!
idő eltelte után!
Állapotváltozás, I. főtétel
- Készítsen vázlatos ábrát ideális gáz
- a) izochor,
- b) izobár,
- c) izoterm és
- d) adiabatikus
- állapotváltozásáról
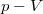 ,
, 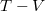 és
és 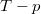 koordináta-rendszerekben úgy, hogy a kiindulási állapot minden esetben ugyanaz legyen!
koordináta-rendszerekben úgy, hogy a kiindulási állapot minden esetben ugyanaz legyen!
- Ábrázolja vázlatosan ideális gáz
- a) izochor,
- b) izobár,
- c) izoterm és
- d) adiabatikus
- állapotváltozásánál a belső energiának a hőmérséklettől-, térfogattól- és a nyomástól való függését! Legyen a belső energia az ordináta, és minden folyamatnál legyen ugyanaz a kiindulási állapot!
- Állapítsuk meg, milyen összefüggés van egy ideális gáz által állandó nyomáson végzett
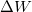 munka, a gázzal közölt
munka, a gázzal közölt 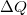 hőmennyiség és a
hőmennyiség és a 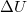 belső energia-változás között, ha a
belső energia-változás között, ha a 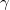 fajhőviszony ismert!
fajhőviszony ismert!
- Ha egy rendszert az ábrán látható 1 úton viszünk az
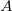 állapotból a
állapotból a 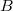 állapotba,
állapotba, 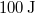 hőt vesz fel, miközben
hőt vesz fel, miközben 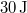 munkát végez.
munkát végez.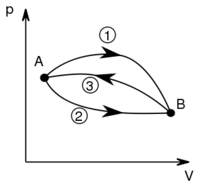
- a) Mennyi hőt vesz fel a rendszer az
 és
és  állapotok közt a 2 úton, ha közben
állapotok közt a 2 úton, ha közben  munkát végez?
munkát végez?
- b) Ha
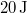 munkával vihetjük a rendszert
munkával vihetjük a rendszert 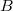 -ből
-ből 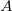 -ba a 3 út mentén, mennyi a közben leadott hő?
-ba a 3 út mentén, mennyi a közben leadott hő?
- a) Mennyi hőt vesz fel a rendszer az
- Mutassa meg, hogy ideális gáz izoterm összenyomásánál a kompresszibilitás
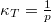 , míg adiabatikus összenyomásnál
, míg adiabatikus összenyomásnál 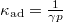 , ahol
, ahol 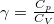 .
.
- A
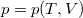 állapotegyenlet ismeretében fejezzük ki a
állapotegyenlet ismeretében fejezzük ki a 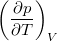 mennyiséget a
mennyiséget a 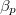 hőtágulási együttható és a
hőtágulási együttható és a 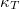 izotermikus kompresszibilitás segítségével!
izotermikus kompresszibilitás segítségével!
- Egy
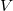 térfogatú szobában befűtünk. A szobában a hőmérséklet eközben állandó légköri nyomáson
térfogatú szobában befűtünk. A szobában a hőmérséklet eközben állandó légköri nyomáson 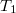 -ről
-ről 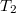 -re nő. Mennyivel változik a szobában lévő levegő belső energiája?
-re nő. Mennyivel változik a szobában lévő levegő belső energiája?
- Egy kezdetben
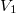 térfogatú,
térfogatú, 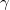 fajhőviszonyú ideális gáz térfogatát
fajhőviszonyú ideális gáz térfogatát 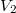 -re növeljük. A folyamatot egyszer adiabatikusan, másodszor pedig izotermikusan hajtjuk végre. Az első és második végállapotban a nyomások aránya
-re növeljük. A folyamatot egyszer adiabatikusan, másodszor pedig izotermikusan hajtjuk végre. Az első és második végállapotban a nyomások aránya 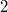 . Mekkora a
. Mekkora a 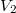 térfogat?
térfogat?
- Van der Waals-gázok belső energiájának térfogatfüggése az alábbi összefüggéssel adható meg: ahol
![\[ U = c_V mT - \frac{m^2}{M^2}\frac{a}{V},\]](/images/math/b/4/7/b47f383e5a17bd995a4937b18f1989c8.png)
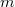 a gáz tömege,
a gáz tömege, 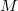 a móltömeg,
a móltömeg, 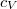 az állandó térfogaton mért fajhő,
az állandó térfogaton mért fajhő,  állandó.
állandó.
Egy hőszigetelt tartályt rögzített, jó hővezető anyagból készített fal választ két részre, amelyekbe azonos tömegű Van der Waals-gázt vezettünk be. A kezdeti állapotjellemzők: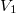 ,
, 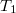 , illetve
, illetve 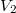 ,
, 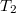 .
.
- a) Mennyi lesz a végső egyensúlyi hőmérséklet?
- b) Hogyan módosul a válasz, ha a gáz betöltése után az elválasztó falat rögtön kivesszük?
- Kondenzált (folyadék vagy szilárd) anyagok egyik közelítő állapotegyenlete Mi az
![\[V= V_0(1-ap+bT).\]](/images/math/3/2/d/32dfd83af77dc0541a76a1b499f794f8.png)
 és
és 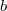 paraméterek jelentése?
paraméterek jelentése?
- Szilárd testek hőtágulási együtthatója, illetve izotermikus kompresszibilitása alacsony hőmérsékleten az alábbi összefüggésekkel adható meg: (
![\[ \beta_p = \frac{3aT^3}{V},\qquad \kappa_T=\frac{b}{V} \]](/images/math/c/4/5/c452cee6e528e707dc57f0f8a8cb00da.png)
 és
és 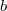 állandók). Határozzuk meg a szilárd test ilyenkor érvényes állapotegyenletét!
állandók). Határozzuk meg a szilárd test ilyenkor érvényes állapotegyenletét!
- Fejezzük ki a
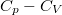 különbséget
különbséget 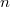 mol Van der Waals-gáz esetén a hőmérséklet, a térfogat és a
mol Van der Waals-gáz esetén a hőmérséklet, a térfogat és a 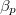 hőtágulási együttható segítségével!
hőtágulási együttható segítségével!
Fajhő, Körfolyamatok
- Melegszik vagy lehűl az
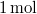 ideális gáz, ha a
ideális gáz, ha a 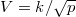 összefüggés (
összefüggés (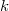 állandó) szerint tágul ki? Mekkora a gáz mólhője ebben a folyamatban, ha állandó térfogaton mért mólhője
állandó) szerint tágul ki? Mekkora a gáz mólhője ebben a folyamatban, ha állandó térfogaton mért mólhője 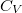 ?
?
- Határozzuk meg azon lehetséges folyamatokat megadó összefüggést, amelyek közben az ideális gáz mólhője állandó (az állandó nyomáson és állandó térfogaton mért mólhőket tekintsük ismertnek)! Vezessük le a kapott egyenletből az ismert, állandó mólhőjű speciális folyamatok egyenletét.
- Ideális gáz állapotváltozását a
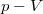 síkon a
síkon a 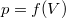 összefüggés írja le.
összefüggés írja le.
- a) Bizonyítsa be, hogy ebben a folyamatban a fajhő térfogatfüggését a összefüggés adja meg!
![\[c(V)=c_V+R\frac{f(V)}{f(V)+V\frac{\mathrm{d}f}{\mathrm{d}V}}\]](/images/math/9/5/f/95f7a48280858181d4b28ca447b3a9d2.png)
- b) Milyen
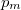 ,
, 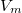 értékpárnál maximális a gáz hőmérséklete, ha az állapotváltozást a
értékpárnál maximális a gáz hőmérséklete, ha az állapotváltozást a 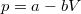 egyenlet adja meg (
egyenlet adja meg ( és
és 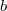 ismert pozitív állandók)?
ismert pozitív állandók)?
- a) Bizonyítsa be, hogy ebben a folyamatban a fajhő térfogatfüggését a
- Az első ábrán egy ideális gázzal végzett körfolyamat
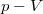 diagramja látható. Ábrázoljuk a folyamatot
diagramja látható. Ábrázoljuk a folyamatot 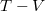 és
és 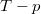 diagramon!
diagramon!
- A második ábrán egy ideális gázzal végzett körfolyamat
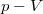 diagramja látható. Mekkora a gáz által végzett munka?
diagramja látható. Mekkora a gáz által végzett munka?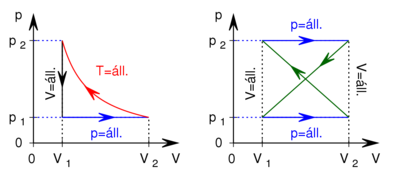
-
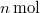 ,
, 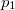 nyomású kétatomos ideális gázt
nyomású kétatomos ideális gázt 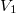 térfogatról állandó nyomáson
térfogatról állandó nyomáson 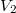 térfogatúra nyomunk össze (az ábrán 1-es út). Ezen az állandó térfogaton eredeti hőmérsékletére melegítjük (2-es út), majd izotermikusan a kiinduló térfogatára tágítjuk (3-as út).
térfogatúra nyomunk össze (az ábrán 1-es út). Ezen az állandó térfogaton eredeti hőmérsékletére melegítjük (2-es út), majd izotermikusan a kiinduló térfogatára tágítjuk (3-as út).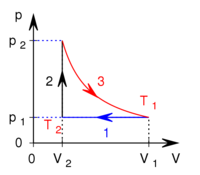
- a) Mennyivel változott a gáz belső energiája az 1-es úton?
- b) Mennyivel hőt kellet közölnünk a gázzal a 2-es úton?
- c) Mekkora a gáz által végzett munka és a gáz által felvett hő a teljes körfolyamatban?
- Egy Carnot-hűtőgép egyik hőtartályában
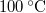 hőmérsékletű, forrásban lévő víz, a másikban
hőmérsékletű, forrásban lévő víz, a másikban 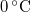 hőmérsékletű víz van. A víz forráshője
hőmérsékletű víz van. A víz forráshője 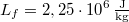 , a jég olvadáshője
, a jég olvadáshője 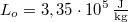 .
.
- a) Mennyi vizet kell az alsó hőtartályban
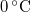 hőmérsékletű jéggé fagyasztani ahhoz, hogy a felső hőtartályban
hőmérsékletű jéggé fagyasztani ahhoz, hogy a felső hőtartályban 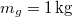 tömegű
tömegű 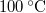 hőmérsékletű gőz keletkezzék?
hőmérsékletű gőz keletkezzék?
- b) Mennyi külső munkát kell a körfolyamatba betáplálni?
- a) Mennyi vizet kell az alsó hőtartályban
- Az ábrán a
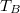 és
és 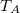 hőmérsékletekkel meghatározott körfolyamat látható. Mekkora annak a gépnek a hatásfoka, amelyik ezt a körfolyamatot mólnyi mennyiségű, adott
hőmérsékletekkel meghatározott körfolyamat látható. Mekkora annak a gépnek a hatásfoka, amelyik ezt a körfolyamatot mólnyi mennyiségű, adott 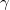 fajhőviszonyú ideális gázzal valósítja meg?
fajhőviszonyú ideális gázzal valósítja meg?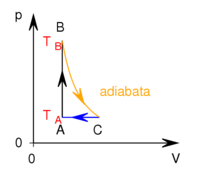
-
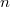 mólnyi ideális gáz az ábrán látható körfolyamatot végzi. A körfolymat két izobár és két adiabata szakaszból áll, amelyeket a
mólnyi ideális gáz az ábrán látható körfolyamatot végzi. A körfolymat két izobár és két adiabata szakaszból áll, amelyeket a 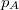 ,
, 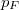 ,
, 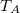 és
és 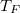 adatok határoznak meg (ez a gőzgép sémája).
adatok határoznak meg (ez a gőzgép sémája).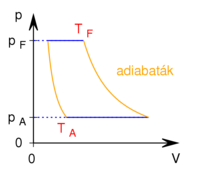
- a) Mekkora a gőzgép hatásfoka?
- b) Hogyan függ a hatásfok attól, hogy hány atomos gázmolekulákkal végezzük a körfolyamatot?
- c) Az adott gépnél és az adott gáznál hogyan növelhető a hatásfok?
- Egy épület fűtésére az ún. dinamikus fűtést használjuk:
- A fűtőanyagot elégetjük egy hőerőgép tűzszekrényében, melynek hőmérsékletét állandó
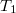 hőmérsékleten tartjuk (ez a hőerőgép felső hőtartálya).
hőmérsékleten tartjuk (ez a hőerőgép felső hőtartálya).
- A hőerőgép egy hőszivattyút működtet, amelynek alsó hőtartálya egy tó
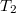 hőmérsékletű vize, felső hőtartálya pedig a hőerőgépet hűtő
hőmérsékletű vize, felső hőtartálya pedig a hőerőgépet hűtő  hőmérsékletű víz, amely az épületet egyúttal fűti (
hőmérsékletű víz, amely az épületet egyúttal fűti ( ).
).
- A tűzszekrényben
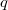 égéshőjű anyag ég, a hőerőgép és a hőszivattyú veszteség nélkül, Carnot-hatásfokkal működik. Határozzuk meg, mennyi hőt kap a helyiség egységnyi tömegű fűtőanyag elégetése árán!
égéshőjű anyag ég, a hőerőgép és a hőszivattyú veszteség nélkül, Carnot-hatásfokkal működik. Határozzuk meg, mennyi hőt kap a helyiség egységnyi tömegű fűtőanyag elégetése árán!
- A fűtőanyagot elégetjük egy hőerőgép tűzszekrényében, melynek hőmérsékletét állandó
Entrópia, II. főtétel
-
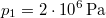 nyomású,
nyomású, 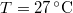 hőmérsékletű és
hőmérsékletű és 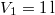 térfogatú ideális gáz izotermikusan
térfogatú ideális gáz izotermikusan 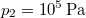 nyomásig terjed ki. Mennyivel változott meg eközben az entrópiája?
nyomásig terjed ki. Mennyivel változott meg eközben az entrópiája?
- Mennyivel változik meg
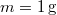 nitrogéngáz entrópiája, ha állandó nyomáson
nitrogéngáz entrópiája, ha állandó nyomáson 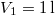 térfogatról
térfogatról 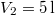 térfogatra expandáltatjuk.
térfogatra expandáltatjuk.
- Tekintsünk
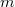 tömegű,
tömegű, 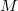 móltömegű,
móltömegű, 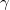 fajhőviszonyú ideális gázt.
fajhőviszonyú ideális gázt.
- a) Vezesse le az entrópia hőmérséklet- és térfogatfüggését megadó összefüggést!
- b) A kapott entrópia-kifejezés segítségével vezesse le az adiabata egyenletét!
- Az ideális gáz entrópiáját gyakran az
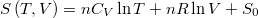 alakban használják.
alakban használják.
- a) Indokolja meg, hogy az
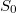 mennyiségnek függnie kell a rendszer anyagmennyiségét megadó
mennyiségnek függnie kell a rendszer anyagmennyiségét megadó 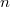 mólszámtól!
mólszámtól!
- b) Adjon meg egy olyan
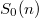 -függést, amellyel az entrópia fenti kifejezése teljesíti az a) pontban szereplő követelményt!
-függést, amellyel az entrópia fenti kifejezése teljesíti az a) pontban szereplő követelményt!
- a) Indokolja meg, hogy az
-
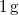
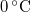 -os víz állandó nyomáson
-os víz állandó nyomáson 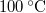 -os gőzzé alakul. Határozzuk meg a folyamat alatt bekövetkező entrópiaváltozást!.
-os gőzzé alakul. Határozzuk meg a folyamat alatt bekövetkező entrópiaváltozást!.
-
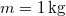 tömegű,
tömegű, 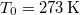 hőmérsékletű vizet termikus kapcsolatba hozunk egy
hőmérsékletű vizet termikus kapcsolatba hozunk egy 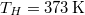 hőmérsékletű hőtartállyal.
hőmérsékletű hőtartállyal.
- a) Mekkora a víz entrópia-változása, miután a hőmérséklete elérte a hőtartály hőmérsékletét?
- b) Mekkora eközben a hőtartály entrópia-változása?
- c) Mekkora a teljes rendszerben (hőtartály és víz) létrejött entrópia-változás?
- d) Mennyi a teljes rendszerben létrejött entrópia-változás, ha a testet először egy
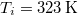 hőmérsékletű hőtartállyal, majd az egyensúly beállta után a
hőmérsékletű hőtartállyal, majd az egyensúly beállta után a 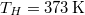 hőmérsékletű hőtartállyal hozzuk kapcsolatba?
hőmérsékletű hőtartállyal hozzuk kapcsolatba?
- e) Lehet-e úgy melegíteni a vizet, hogy a teljes rendszer entrópia-változása kisebb legyen egy előírt értéknél (vagyis a folyamat előírt mértékben megközelítse a reverzíbilis folyamatot)?
- Tekintsünk ideális gázzal végzett Carnot-körfolyamatot.
- a) Ábrázoljuk a Carnot-körfolyamatot
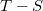 diagramban!
diagramban!
- b) Mutassuk ki, hogy a körfolyamatban a gáz által végzett munka most is a körfolyamat területével egyenlő!
- c) Számítsuk ki a fentiek alapján a Carnot-körfolyamat hatásfokát!
- a) Ábrázoljuk a Carnot-körfolyamatot
- Egymástól válaszfallal elzárt,
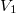 és
és 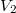 térfogatú két edényben azonos hőmérsékletű, azonos nyomású,
térfogatú két edényben azonos hőmérsékletű, azonos nyomású, 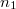 és
és 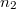 mólszámú, különböző fajtájú ideális gáz van. Ha a válaszfalat eltávolítjuk, akkor a két gáz összekeveredik.
mólszámú, különböző fajtájú ideális gáz van. Ha a válaszfalat eltávolítjuk, akkor a két gáz összekeveredik.
- a) Indokoljuk meg, hogy a folyamatban miért nem változik a hőmérséklet és a nyomás!
- b) Határozzuk meg az entrópia-változást (az ún. keverési entrópiát), és fejezzük ki a gázok
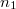 és
és 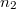 mólszámaival!
mólszámaival!
- c) Számítsuk ki az entrópia-változást, ha a két edényben azonos fajtájú gáz van!
-
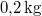 ,
, 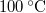 hőmérsékletű vasat hőszigetelt kaloriméterben lévő,
hőmérsékletű vasat hőszigetelt kaloriméterben lévő, 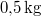 ,
, 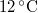 -os vízbe teszünk. A vas fajhője
-os vízbe teszünk. A vas fajhője 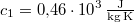 , a vízé
, a vízé 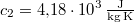 . Mennyi az entrópiaváltozás a hőmérséklet kiegyenlítődése miatt, ha a nyomás állandó?
. Mennyi az entrópiaváltozás a hőmérséklet kiegyenlítődése miatt, ha a nyomás állandó?
- Két test azonos
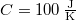 hőkapacitású, de hőmérsékletük különböző:
hőkapacitású, de hőmérsékletük különböző: 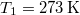 ,
, 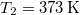 .
.
- a) Mennyi lesz a közös hőmérsékletük, ha termikus kapcsolatba hozzuk őket úgy, hogy a környezet felé ne legyen hőátadás?
- b) Mennyi lesz a közös hőmérséklet, ha a kiegyenlítődést egy reverzíbilisen működő hőerőgép végzi?
- c) Ha a kiegyenlítődés nem jár térfogatváltozással, mekkora lesz a két esetben a belső energia megváltozása és az entrópia-változás?
Homogén rendszerek
- Bizonyítsuk be a
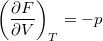 ,
, 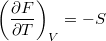 ,
, 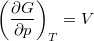 és
és 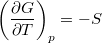 összefüggéseket!
összefüggéseket!
- Bizonyítsuk be a
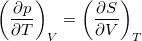 Maxwell-összefüggést!
Maxwell-összefüggést!
- Állandó anyagmennyiségű homogén rendszerben termikus és mechanikai kölcsönhatás esetén fennáll a
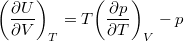 egyenlet. A fenti egyenlet levezetésének mintájára bizonyítsuk be, hogy ha a termikus kölcsönhatás mellett tetszőleges –
egyenlet. A fenti egyenlet levezetésének mintájára bizonyítsuk be, hogy ha a termikus kölcsönhatás mellett tetszőleges – 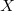 intenzív- és
intenzív- és 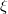 extenzív mennyiségpárral jellemzett – kölcsönhatás lép fel, akkor a fenti egyenlet érvényes marad, ha végrehajtjuk a
extenzív mennyiségpárral jellemzett – kölcsönhatás lép fel, akkor a fenti egyenlet érvényes marad, ha végrehajtjuk a 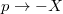 és a
és a 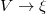 változócserét!
változócserét!
- Fejezzük ki mérhető mennyiségekkel (hőtágulási együttható, kompresszibilitás, mólhő) egy rendszer
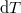 hőmérséklet-változását, ha térfogata adiabatikus, kvázisztatikus folyamat során
hőmérséklet-változását, ha térfogata adiabatikus, kvázisztatikus folyamat során 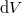 -vel megváltozik! Mutassuk meg, hogy
-vel megváltozik! Mutassuk meg, hogy  alatt a víz adiabatikus, kvázisztatikus összenyomáskor lehűl!
alatt a víz adiabatikus, kvázisztatikus összenyomáskor lehűl!
- Feltételezve, hogy
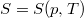 , mutassuk ki, hogy
, mutassuk ki, hogy 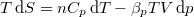 , ahol
, ahol 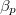 az izobár hőtágulási együttható.
az izobár hőtágulási együttható.
- Az első főtétel és a termodinamika differenciálegyenletei felhasználásával mutassuk meg, hogy ha ismerjük egy állandó anyagmennyiségű rendszer belső energiáját a térfogat és az entrópia függvényeként (vagyis az
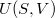 függvényt), akkor a rendszer bármely állapotjelzője (nyomás, hőmérséklet, entalpia, stb.) megadható
függvényt), akkor a rendszer bármely állapotjelzője (nyomás, hőmérséklet, entalpia, stb.) megadható 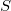 és
és 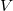 függvényeként!
függvényeként!
- Mennyivel változik egy
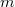 tömegű,
tömegű,  hőmérsékletű,
hőmérsékletű, 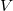 térfogatú rendszer entrópiája, ha térfogata állandó nyomáson
térfogatú rendszer entrópiája, ha térfogata állandó nyomáson 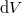 értékkel megnő? Az állandó nyomáson mért
értékkel megnő? Az állandó nyomáson mért 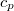 fajhőt és a
fajhőt és a 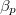 hőtágulási együtthatót ismertnek tekintjük.
hőtágulási együtthatót ismertnek tekintjük.
- Egy rendszer állapotegyenlete
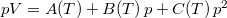 , ahol a hőmérsékletfüggő együtthatók kísérletekből ismertek. Mennyit változik a rendszer szabad entalpiája és entrópiája, ha a nyomást rögzített
, ahol a hőmérsékletfüggő együtthatók kísérletekből ismertek. Mennyit változik a rendszer szabad entalpiája és entrópiája, ha a nyomást rögzített  hőmérsékleten
hőmérsékleten 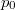 -ról
-ról 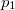 -re változtatjuk?
-re változtatjuk?
- Egy gumiszalag állapotegyenlete
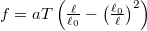 alakba írható, ahol
alakba írható, ahol 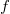 a szalagban fellépő húzóerő nagysága,
a szalagban fellépő húzóerő nagysága, 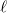 a szalag hossza,
a szalag hossza,  a hőmérséklet,
a hőmérséklet, 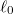 a szalag erőmentes hossza,
a szalag erőmentes hossza,  pozitív állandó.
pozitív állandó.
- a) Mutassuk ki, hogy a belső energia nem függ a szalag hosszától!
- b) Írjuk fel a termodinamika fundamentális egyenletét, továbbá a szabad energia és a szabad entalpia megváltozását a gumiszalagra!
- c) Mekkora munkát végzünk, és mennyi a gumiszalag által leadott hő, ha a szalag hosszát izotermikus, reverzíbilis folyamatban
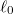 -ról
-ról 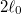 -ra növeljük.
-ra növeljük.
- d) Igazoljuk, hogy a gumiszalag hőmérséklete megnő, ha adiabatikusan megnyújtjuk!
- Mennyi hő szabadul fel az
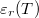 dielektromos állandójú dielektrikum polarizációjakor, ha a külső elektromos tér nagyságát állandó hőmérsékleten, kvázi-stacionáriusan növeljük nulláról egy nem túl nagy
dielektromos állandójú dielektrikum polarizációjakor, ha a külső elektromos tér nagyságát állandó hőmérsékleten, kvázi-stacionáriusan növeljük nulláról egy nem túl nagy 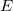 értékre? A térfogatváltozás elhanyagolható.
értékre? A térfogatváltozás elhanyagolható.
Fázisátalakulások
- Mutassuk meg, hogy mechanikai- és termikus kölcsönhatásban részt vevő rendszerben állandó nyomáson végbemenő fázisátalakulásnál az átalakulási hő (
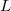 ) az entalpiaváltozással (
) az entalpiaváltozással (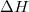 ) egyenlő!
) egyenlő!
-
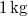 víznek normál nyomáson (
víznek normál nyomáson (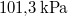 ) való elforralásához egy elektromos merülőforralón a
) való elforralásához egy elektromos merülőforralón a 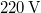 -os feszültségforrásból
-os feszültségforrásból 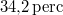 -en át
-en át 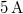 áramot kell átfolyatni. A gázállandó
áramot kell átfolyatni. A gázállandó 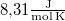 , a víz moláris tömege
, a víz moláris tömege 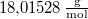 .
.
Határozzuk meg a víz- a) entalpia-,
- b) entrópia- és
- c) belső energiaváltozását ebben a folyamatban!
- Henger alakú edényben
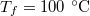 hőmérsékletű telített vízgőz van. Egy súlytalan dugattyú lassú betolásának hatására az edényben
hőmérsékletű telített vízgőz van. Egy súlytalan dugattyú lassú betolásának hatására az edényben 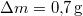 víz lecsapódik. A víz moláris tömege
víz lecsapódik. A víz moláris tömege 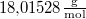 A folyamat során a nyomás a
A folyamat során a nyomás a 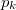 külső légnyomással egyenlő.
külső légnyomással egyenlő.
Mennyi munkát végeztünk ezalatt az ideális gáznak tekinthető vízgőzön?
- Ábrázoljuk (kvalitatív módon) egy tiszta anyag kémiai potenciáljának
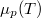 hőmérsékletfüggését állandó nyomáson, az anyag szilárd-, folyadék- és gőzállapotát átfogó hőmérséklet-intervallumban! Az olvadáspontot
hőmérsékletfüggését állandó nyomáson, az anyag szilárd-, folyadék- és gőzállapotát átfogó hőmérséklet-intervallumban! Az olvadáspontot 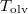 -val, a forráspontot
-val, a forráspontot 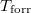 -ral jelöljük, és tegyük fel, hogy a mólentrópia egy fázison belül nem függ a hőmérséklettől!
-ral jelöljük, és tegyük fel, hogy a mólentrópia egy fázison belül nem függ a hőmérséklettől!
- Felhasználva, hogy az olvadáspont az állandó nyomáson felvett
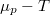 diagramban a szilárd fázisra és a folyadékra érvényes görbék metszéspontjánál van mutassuk ki, hogy a nyomás növelésekor az olvadáspont nő, ha a szilárd fázis móltérfogata kisebb, mint a folyadéké! Hogyan változik a jég olvadáspontja, a nyomás növelésekor?
diagramban a szilárd fázisra és a folyadékra érvényes görbék metszéspontjánál van mutassuk ki, hogy a nyomás növelésekor az olvadáspont nő, ha a szilárd fázis móltérfogata kisebb, mint a folyadéké! Hogyan változik a jég olvadáspontja, a nyomás növelésekor?
- A szilárd-folyadék egyensúlyi görbének (olvadási görbe) közelítő meghatározására gyakran használják a
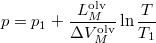 összefüggést (
összefüggést (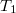 a
a 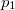 nyomáson,
nyomáson,  a
a 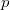 nyomáson érvényes olvadáspont, az egyenletben szereplő
nyomáson érvényes olvadáspont, az egyenletben szereplő 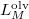 az anyag moláris átalakulási hője (vagy moláris entalpiaváltozása),
az anyag moláris átalakulási hője (vagy moláris entalpiaváltozása), 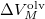 pedig a móltérfogat változása az olvadásnál).
pedig a móltérfogat változása az olvadásnál).
- a) Vezessük le ezt az egyenletet, és állapítsuk meg, hogy milyen feltételek mellett érvényes!
- b) Mutassuk ki, hogy a
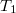 -hez képest kis
-hez képest kis  érték eseten az egyensúlyi nyomás lineárisan változik a
érték eseten az egyensúlyi nyomás lineárisan változik a  különbséggel!
különbséggel!
- A jég olvadáshője
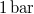 nyomáson
nyomáson 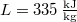 . A jég és a víz fajlagos térfogatának aránya
. A jég és a víz fajlagos térfogatának aránya 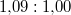 . Becsüljük meg, mennyivel tolódik el az olvadáspont kis nyomásnövekedés hatására!
. Becsüljük meg, mennyivel tolódik el az olvadáspont kis nyomásnövekedés hatására!
- Ha a nyomást
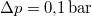 -ral megnöveljük, akkor a víz forrási hőmérséklete
-ral megnöveljük, akkor a víz forrási hőmérséklete 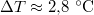 -kal növekszik. Ennek felhasználásával becsüljük meg a víz forráshőjét!
-kal növekszik. Ennek felhasználásával becsüljük meg a víz forráshőjét!
- A szilárd argon
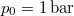 nyomáson
nyomáson 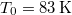 hőmérsékleten olvad meg. Olvadáshője ekkor
hőmérsékleten olvad meg. Olvadáshője ekkor 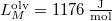 , móltérfogatának változása
, móltérfogatának változása 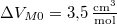 . A nyomás növekedésekor kísérleti eredmények szerint az olvadáshő nem változik, a
. A nyomás növekedésekor kísérleti eredmények szerint az olvadáshő nem változik, a 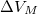 móltérfogatváltozás viszont az abszolút hőmérséklet megközelítőleg
móltérfogatváltozás viszont az abszolút hőmérséklet megközelítőleg 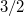 -ik hatványával arányos.
-ik hatványával arányos.
Mekkora nyomást kell alkalmaznunk ahhoz, hogy az olvadási hőmérséklet megkétszereződjék?
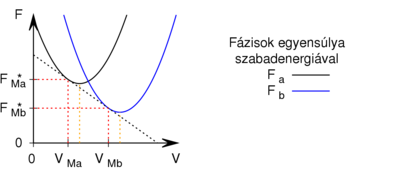
- Egy homogén anyag adott hőmérsékleten két fázisban (
 és
és 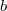 ) létezhet. Az egyes fázisok moláris szabad energiáinak térfogattól való függése (rögzített hőmérsékleten, állandó anyagmennyiség esetén) az ábrán látható.
) létezhet. Az egyes fázisok moláris szabad energiáinak térfogattól való függése (rögzített hőmérsékleten, állandó anyagmennyiség esetén) az ábrán látható.
Mutassuk ki, hogy egyensúlyi állapotban a fázisok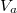 és
és 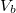 térfogatai a két görbéhez húzott közös érintő érintési pontjainak abszcisszái, a közös nyomás pedig az érintő negatív iránytangense!
térfogatai a két görbéhez húzott közös érintő érintési pontjainak abszcisszái, a közös nyomás pedig az érintő negatív iránytangense!
- Az ábrán különböző mennyiségek hőmérsékletfüggését mutatjuk be a
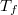 fázisátalakulási hőmérséklet környezetében. Az ábrák közül melyik tartozhat elsőrendű és melyik másodrendű fázisátalakuláshoz?
fázisátalakulási hőmérséklet környezetében. Az ábrák közül melyik tartozhat elsőrendű és melyik másodrendű fázisátalakuláshoz?

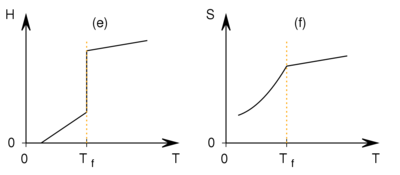

Kvantummechanikai bevezető
- Nyári napsütésben, délben a Föld felszínének
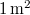 -én átlagosan kb.
-én átlagosan kb. 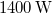 napsugárzási teljesítmény mérhető. Becsüljük meg a Nap felszínének hőmérsékletét!
napsugárzási teljesítmény mérhető. Becsüljük meg a Nap felszínének hőmérsékletét!
(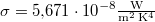 )
)
- Egy izzólámpában a volfrámszál hőmérséklete kb.
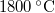 . Az emberi szem a
. Az emberi szem a 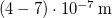 hullámhossz tartományban lát. Becsülje meg az izzólámpa „hatásfokát”!
hullámhossz tartományban lát. Becsülje meg az izzólámpa „hatásfokát”!
- Határozzuk meg, hogy egy
 hőmérséklet fekete test milyen foton-áramsűrűséggel sugároz!
hőmérséklet fekete test milyen foton-áramsűrűséggel sugároz!
- Egy
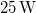 -os megfelelő gázzal töltött lámpától
-os megfelelő gázzal töltött lámpától 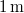 -re egy tantál fémfelületet (
-re egy tantál fémfelületet (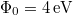 ) helyezünk el. A klasszikus elmélet alapján becsülje meg, hogy egy elektron átlagosan mennyi idő alatt gyűjtene össze annyi energiát, amivel kiléphet a fémből!
) helyezünk el. A klasszikus elmélet alapján becsülje meg, hogy egy elektron átlagosan mennyi idő alatt gyűjtene össze annyi energiát, amivel kiléphet a fémből!
(A valóságban a fotoeffektus során az elektronok a megvilágításkor „azonnal” kilépnek a fémből.)
- Határozza meg, hogy a Compton-szórás esetén a beeső foton energiájának hány százalékát adja le az elektronnak!
- Vizsgáljuk meg, hogy létezik-e olyan effektus, hogy egy szabad elektron teljes egészében elnyel egy fotont (teljesen rugalmatlan ütközés)! Ennek fényében, hogyan magyarázható a fotoeffektus?
- Alkalmazza a Bohr–Sommerfeld-féle kvantálási hipotézist körpályán mozgó elektronra és egy lineáris oszcillátorra! Magyarázza meg a szupravezetésnél fellépő „fluxuskvantálás” jelenségét a Bohr–Sommerfeld-féle kvantálási hipotézis segítségével!
- Számítsa ki a hidrogénatom Bohr-féle modelljében a „körpályán” keringő elektron pályasugarát, sebességét, perdületét és energiáját!
- Számítsa ki, hogy a hidrogénatom Bohr-féle modelljében a relativisztikus tömegnövekedés milyen korrekciót jelentene az energiaszintekben!
- Számítsa ki, hogy a hidrogénatom Bohr-féle modelljében a mag véges nagyságú tömege milyen korrekciót jelentene az energiaszintekben és a spektrumban!
- Határozza meg, hogy az atomok fotonkibocsátásakor fellépő visszalökődés milyen korrekciót jelent az emissziós spektrumban!
- Mutassa meg, hogy miként teljesül a „korrespondencia-elv” a hidrogénatom Bohr-féle modelljében a fénykibocsátása esetén!
- Hasonlítsa össze a foton és az elektron kinetikus energia-hullámszám görbéjét! Elemezze a lehetséges jellegzetességeket relativisztikus, és nemrelativisztikus esetekben!
- Határozza meg a Schrödinger-féle hidrogénatomban az elektron alapállapoti hullámfüggvényét! Számítsa ki, hogy protontól milyen távolságban található meg az elektron a legnagyobb valószínűséggel!
![\[p=\frac{2U}{3V}\]](/images/math/7/9/a/79a5ef5aee3e9a6d7f09326b91f3a4b4.png)
![\[x=\frac{\omega R^2}{v}\]](/images/math/0/b/6/0b64d775cd07f10acdc2f74976361052.png)
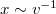 összefüggést.
összefüggést. ![\[v_m=\sqrt{\frac52}\,v_0,\]](/images/math/b/b/e/bbec4f31fa99ad4b348e8f27cca0b017.png)
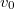 a legvalószínűbb sebesség.
a legvalószínűbb sebesség. ![\[f(w)=\frac{4}{v_0\sqrt{\pi}}\frac{1}{w_v\sqrt{2\mu}}\sqrt{w} \exp\left\{ -\frac{w}{w_v} \right\}, \text{ ahol } w_v=\frac12 \mu v_0^2=kT\]](/images/math/4/6/e/46ed18cb6e204a14b7d02f1f6f168d50.png)
![\[w_0=\frac12kT,\qquad \langle w\rangle=\frac32kT\]](/images/math/3/a/7/3a7857f15c6a811008e25cebad3e2a36.png)
![\[p<\frac{kT}{2\sqrt{2}\, R \, d^2\pi}=0{,}188\,\mathrm{Pa},\]](/images/math/f/1/3/f13f6dbd41c6c990671c0eb82ccfe194.png)
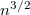 -szeres,
-szeres, 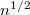 -szeres.
-szeres. ![\[N(t)=n_0\exp\{-t/\tau\},\]](/images/math/0/f/6/0f66732b3648dd5d9e4a439bd08de0d9.png)
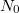 a kezdeti részecskeszám-sűrűség,
a kezdeti részecskeszám-sűrűség, 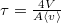 .
. ![\[\tau_{1/2}=\tau \ln 2\]](/images/math/8/9/8/8988e91daa948b7308b8d2c1d7b6f229.png)
![\[T(z)=T_1+\frac{T_2-T_1}{d}z\]](/images/math/b/6/5/b6576fbfcb4cdb76f8702fbc59f78dae.png)
![\[t(Z) = \left(\frac{\rho L_o}{2\lambda(T_0-T_\ell)}\right)\,Z^2, \]](/images/math/d/8/7/d876a0a553d038419a342caf35cbffed.png)
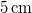 vastag jégréteg.
vastag jégréteg. ![\[T = T_0+\left(T_1-T_0\right)e^{\textstyle -\frac{A\alpha}{cm}t}\]](/images/math/1/3/f/13f20fc241d9d56f3b09002a2987438f.png)
![\[\Delta Q = \frac{\gamma}{\gamma-1}\Delta W = \gamma \Delta U\]](/images/math/8/5/b/85be9e56262f39a875414a126cad154e.png)
![\[\Delta Q = 80\,\rm{J}\]](/images/math/5/c/e/5ce69d1df43da9c44332675f00e619cb.png)
![\[\Delta Q = 90\,\rm{J}\]](/images/math/0/8/c/08ce50a287cbb333107df509b4469cb7.png)
![\[\kappa_{\mathit{ad}}=\frac{1}{\gamma p}\]](/images/math/1/f/e/1feb5ea49c75fe40f04869aa24729ef9.png)
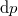 teljes differenciál nulla.
teljes differenciál nulla. ![\[{\left(\frac{\partial p}{\partial T}\right)}_V = \frac{\beta_p}{\kappa_T}\]](/images/math/e/4/9/e496792ff87f32233de1607c8704883d.png)
![\[V_2=V_1\,2\frac{1}{\gamma-1}\]](/images/math/7/d/5/7d587d64171a43d070331fc0db59c195.png)
![\[T=\frac{T_1+T_2}{2}\]](/images/math/4/5/d/45d22e35974fa6f3871ee196153942fb.png)
![\[T=\frac{T_1+T_2}{2}-\frac{ma\left(V_1-V_2\right)^2}{2M^2c_VV_1V_2\left(V_1+V_2\right)}\]](/images/math/7/9/5/795c653443761983b2ab64515717f29d.png)
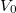 térfogatnál érvényes izotermikus kompresszibilitás és hőtágulási együttható.
térfogatnál érvényes izotermikus kompresszibilitás és hőtágulási együttható. ![\[p=\frac{3a}{4b}T^4+\frac{V_0-V}{b},\]](/images/math/f/0/3/f03818c4d7f756ea3d47cd7ddb4bed96.png)
![\[C_p-C_V=\frac{1}{n}\left(p+\left(\frac{\partial U}{\partial V}\right)_T\right)\left(\frac{\partial V}{\partial T}\right)_p\]](/images/math/c/3/4/c342b7595e6daf4375e0a9e1fafdf029.png)
![\[C_p-C_V=\frac{RT\beta_p}{1-nb/V}.\]](/images/math/a/7/4/a746f69df3bc690df6825fc3ea6c9d2d.png)
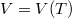 függvényt és abból a
függvényt és abból a 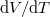 hányadost!
hányadost! ![\[C=C_V-R\]](/images/math/9/1/6/916d05fdbb5dfa7f9b35fed114625c98.png)
![\[pV^\frac{C-C_p}{C-C_V}=\text{állandó}.\]](/images/math/0/8/4/0844c7b8571b41dceb34b69f2c02e722.png)
![\[\frac{\mathrm{d}V}{\mathrm{d}T}=\left(\frac{\mathrm{d}T}{\mathrm{d}V}\right)^{-1}\]](/images/math/c/8/8/c88d2444320e13642d1d1bc1085d8c92.png)
![\[V_m=\frac{a}{2b}\qquad\text{és}\qquad p_m=\frac{a}{2}\]](/images/math/0/4/f/04f5f3e0fd92c07431c1162d1bfa547a.png)
![\[W=0.\]](/images/math/1/5/d/15d71ac95674055e4c06112ae5313e2d.png)
![\[\Delta U_1 = p_1 \frac{V_2-V_1}{\gamma-1}, \qquad \gamma=\frac75\]](/images/math/2/f/6/2f69cad7cc3d66fb56085b61806960b8.png)
![\[\Delta Q_2=-\Delta U_1\]](/images/math/b/4/5/b45afb1d5d8899648966d216d44c756b.png)
![\[\Delta W = \Delta Q = p(V_2-V_1)+p_1V_1\ln\left(\frac{V_1}{V_2}\right)\]](/images/math/4/7/5/475bbd601cdf9182147bca5dfa9123cb.png)
![\[m_j=(1-\eta)L_f m_g/L_o=49{,}16\,\mathrm{kg},\]](/images/math/f/1/4/f147478a59f517a1b7dfabbe7bddefd5.png)
![\[W=\eta L_f m_g=6{,}03\cdot 10^5\,\mathrm{J},\]](/images/math/f/5/9/f59e5efd869a9a6687ee70f425700363.png)
![\[\eta=1-\gamma\frac{x^{1/gamma}-1}{x-1},\]](/images/math/e/e/c/eec4e9f8a52e569065ee348f1a0d0fad.png)
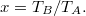
![\[\eta=1-\left(\frac{p_A}{p_F}\right)^{\frac{\gamma-1}{\gamma}}.\]](/images/math/b/0/6/b06b768320fb25e906c3a14c04833bbe.png)
![\[Q=q\frac{1-T_2/T_1}{1-T_2/T}>q.\]](/images/math/0/9/7/097b137e36faa49bbb8b3a3deaab5f04.png)
![\[\Delta S=\frac{p_1 V_1}{T}\ln\frac{p_1}{p_2}=19{,}97\,\mathrm{\frac{J}{K}}\]](/images/math/6/d/0/6d0b864aa264a9c16325151512c98203.png)
![\[\Delta S=\frac{m}{\mu_\mathrm{N_2}}C_p\ln\frac{V_2}{V_1}=3{,}34\,\mathrm{\frac{J}{K}}, \qquad C_p=\frac72R.\]](/images/math/6/9/3/69379145baf5ca7bc790fdc4464b8173.png)
![\[S=\frac{m}{M}R\ln\left(T^{\frac{1}{\gamma-1}}V\right)+S_0\]](/images/math/7/0/3/703497cb4e3daf33126d8a9df9ebb08d.png)
![\[TV^{\gamma-1}=\mathrm{const.}\]](/images/math/7/5/4/754140f6a21d584b63f5d26d9a18a297.png)
![\[S_0(n)=-nR\ln n+ns_0,\]](/images/math/0/f/5/0f5e8e66063357f77affc5dd75e82760.png)
![\[S\left(T,V\right)=n C_V\ln T+nR\ln \frac{V}{n}+ ns_0,\]](/images/math/e/5/8/e580690ef414387f9272cc6ffe11e430.png)
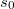 már
már ![\[\Delta S = mc\ln\frac{373}{273}+\frac{mL_f}{373\,\mathrm{K}}=7{,}36\,\mathrm{\frac{J}{K}},\]](/images/math/8/f/f/8ff47ef68c48ff988ac413b430356235.png)
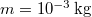 a víz tömege,
a víz tömege, 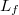 a forráshője.
a forráshője. ![\[1306\,\mathrm{\frac{J}{K}}\]](/images/math/2/d/8/2d8871a7637fa7346587bd1eb82a4c69.png)
![\[-1121\,\mathrm{\frac{J}{K}}\]](/images/math/0/3/9/039511937396c1ce27cf7b567a919c69.png)
![\[185\,\mathrm{\frac{J}{K}}\]](/images/math/0/6/1/06120b7dea96d50e3214e101a83a9563.png)
![\[98\,\mathrm{\frac{J}{K}}\]](/images/math/9/2/9/929c0bc6fa4c0264edcf460bb60e5c28.png)
![\[\Delta S = R n_1 \ln\frac{n_1+n_1}{n_1} + R n_2 \ln\frac{n_1+n_2}{n_2}\]](/images/math/5/9/6/596d530da1c94e91161150cb929bb191.png)
![\[\Delta S=0\]](/images/math/8/1/c/81ca578b10374e17bce8368f5500ff49.png)
![\[T_k=288{,}7\,\mathrm{K},\qquad \Delta S=3{,}41\,\mathrm{\frac{J}{K}}\]](/images/math/b/d/b/bdb4a99b8fe7577d94178ef75c691ba3.png)
![\[T_k=\frac{T_1+T_2}{2}\]](/images/math/e/4/0/e40444a3f717bb0150a6cddb411c076d.png)
![\[T_k=\sqrt{T_1 T_2}\]](/images/math/2/2/5/22549fc9b794cce58ca4c0f18c2725c4.png)
![\[\Delta U_a=0, \qquad \Delta U_b=2C\sqrt{T_1 T_2}-CT_1-CT_2=-778{,}7\,\mathrm{J},\]](/images/math/4/4/a/44a431f68a2caaec70e8da0364f277ff.png)
![\[\Delta S_a=2C\ln\frac{T_1+T_2}{2}-C\ln T_1-C\ln T_2=2{,}42\,\mathrm{\frac{J}{K}}, \qquad \Delta S_b=0.\]](/images/math/7/a/1/7a11e8b14bc0459f04ada0abf724dd1b.png)
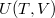 függvény teljes differenciálját, alkalmazzuk a belső energia térfogatfüggésére érvényes összefüggést, és a
függvény teljes differenciálját, alkalmazzuk a belső energia térfogatfüggésére érvényes összefüggést, és a  alatt negatív.
alatt negatív. 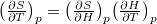 matematikai összefüggést, a termodinamika két differenciális összefüggését és a
matematikai összefüggést, a termodinamika két differenciális összefüggését és a ![\[\mathrm{d}S=\frac{m c_p}{TV\beta_p}\,\mathrm{d}V\]](/images/math/8/9/1/8913482ffd0e5fd05a97ff4d3c990a0a.png)
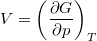 és az
és az 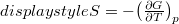 összefüggéseket!
összefüggéseket! ![\[\Delta G=A\ln\left(\frac{p_1}{p_0}\right)+B\left(p_1-p_0\right)+C\frac{p_1^2-p_0^2}{2}\]](/images/math/6/0/4/604b4690f62d9f0616982b2cd9d8dfe5.png)
![\[\Delta S=A'\ln\left(\frac{p_1}{p_0}\right)+B'\left(p_1-p_0\right)+C'\frac{p_1^2-p_0^2}{2},\]](/images/math/9/4/d/94dc473377e76fb6ed5fbb18beabd15f.png)
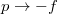 és
és 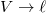 helyettesítéssel.
helyettesítéssel. ![\[\mathrm{d}U=T\mathrm{d}S+f\mathrm{d}\ell\]](/images/math/7/f/5/7f5decf22c82e848373c1a93e96bafaf.png)
![\[W=Q_\text{le}=\int_{\ell_0}^{2\ell_0}f\mathrm{d}\ell\]](/images/math/a/9/2/a92623436a83ffbf664f8f1a1b3458ef.png)
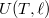 függvény teljes differenciálját, és vegyük figyelembe az (a) részfeladat eredményét!
függvény teljes differenciálját, és vegyük figyelembe az (a) részfeladat eredményét! ![\[\left(\frac{\partial T}{\partial \ell}\right)_S=\frac{f}{C_\ell}>0,\]](/images/math/4/8/f/48fb10b34970193d78d5a4a66ee9c31c.png)
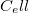 az állandó hossznál mért hőkapacitás.
az állandó hossznál mért hőkapacitás. 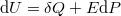 alakját, az
alakját, az 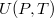 függvény teljes differenciálját, és azt, hogy a belső energia térfogatfüggésére kapott általános összefüggés átírható erre az esetre is a dielektrikum teljes dipólusmomentuma (
függvény teljes differenciálját, és azt, hogy a belső energia térfogatfüggésére kapott általános összefüggés átírható erre az esetre is a dielektrikum teljes dipólusmomentuma (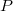 ) segítségével a
) segítségével a  és
és  helyettesítéssel:
helyettesítéssel: 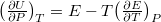 . Alkalmazzuk még a
. Alkalmazzuk még a 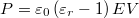 összefüggést is!
összefüggést is! ![\[Q=-\frac12T\varepsilon_0V\frac{\mathrm{d}\varepsilon_r(T)}{\mathrm{d}T}E^2\]](/images/math/7/4/8/748a2556baf501bef94eaf7c54b03a77.png)
![\[\Delta H = W_\text{el} = 2{,}26\,\mathrm{MJ}\]](/images/math/4/f/d/4fdaf5770143071de6a318dd403592b3.png)
![\[\Delta S = 6{,}06\,\mathrm{\frac{kJ}{K}}\]](/images/math/7/2/7/7276d2981b6be7939e2cbb7053cfb7e9.png)
![\[\Delta U=\Delta H-\frac{m}{M}RT=2{,}09\,\mathrm{MJ}\]](/images/math/0/8/9/089fe9b22dd39aba913ca295f3f5cd56.png)
![\[\Delta W=p_k\left(V_1-V_2\right)=\frac{RT_f}{M}\Delta m=120\,\mathrm{J}\]](/images/math/0/1/c/01c0c0abb9f739cbff493a96bc03ec39.png)
![\[\left(\frac{\partial G}{\partial T}\right)_p=-S\]](/images/math/5/d/3/5d3e0ea157a966637bfd4bc7513fc8bd.png)
![\[\left(\frac{\partial \mu }{\partial p}\right)_T= V_M\]](/images/math/2/5/a/25a4030c915d37e859e677c758ddfc3f.png)
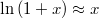 összefüggést.
összefüggést. ![\[\mathrm{d}T=-\frac{0{,}09v_\text{víz}T}{L}\,\mathrm{d}p= -7{,}34\cdot10^{-8}\mathrm{\frac{K}{Pa}}\,\mathrm{d}p\]](/images/math/2/b/7/2b73b88d36a28976c45ec8366c83d6ee.png)
![\[L_f\approx \frac{\Delta p}{\Delta T}\frac{RT^2}{p_kM}=2253\,\mathrm{\frac{kJ}{kg}}\]](/images/math/4/c/7/4c7c0dfc446c66a05097776d64fc920c.png)
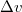 hőmérsékletfüggésének figyelembevételével integráljuk a Clausius-Clapeyron-egyenletet!
hőmérsékletfüggésének figyelembevételével integráljuk a Clausius-Clapeyron-egyenletet! ![\[p=p_0+\frac{2L}{3\Delta v_0}\left(1-\left(\frac{T_0}{T}\right)^{3/2}\right)=1449\,\mathrm{bar}\]](/images/math/b/5/9/b59affbd1e174e38c0177e77ed696768.png)
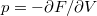 , ill.
, ill. 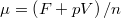 ), és használjuk ki, hogy fázisegyensúlyban a két fázis nyomása és kémiai potenciálja egyenlő!
), és használjuk ki, hogy fázisegyensúlyban a két fázis nyomása és kémiai potenciálja egyenlő! 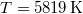
![\[\frac{\Delta \mathcal{E}}{\mathcal{E}_t}=0{,}355\%\]](/images/math/e/a/1/ea1bc4434817421fb132a20eb6e23fd8.png)
![\[N = 2{,}404 \frac{8\pi}{c^2}\left(\frac{kT}{h}\right)^3\]](/images/math/5/2/5/525d3b6c79fc0b7e9c3c5bc6bbcf4e34.png)
![\[\Delta t= \frac{16\Phi_0}{P} \left( \frac{\ell}{D_\mathrm{Ta}} \right)^2 = 4{,}88\,\mathrm{s}\]](/images/math/a/9/0/a90e4994c9b40edbfb9deab6614d74db.png)
![\[\eta = 1 - \left(\frac{p_f(1-\cos\vartheta)}{m_e c}+1\right)^{-1},\]](/images/math/e/3/d/e3d6a9c5338b3763b4cad5550a858ae6.png)
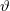 a foton eltérülése eredeti irányától.
a foton eltérülése eredeti irányától. 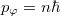 , lineáris oszcillátorra
, lineáris oszcillátorra 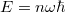 .
. ![\[ v_n = \frac{v_0}{n}, \qquad r_n = a_0 n^2,\]](/images/math/b/e/f/befdf1be2cd0570bc1714f3c8617241f.png)
![\[L_n = n\hbar, \qquad E_n = -\frac{E_0}{n^2}, \]](/images/math/f/b/6/fb6b76901bce25c085edd4b2973f8e77.png)
![\[v_0 = \frac{e^2}{4\pi\varepsilon_0\hbar}, \qquad a_0 = \frac{\hbar^2 4 \pi \varepsilon_0}{m_e e^2}, \]](/images/math/4/9/9/4999909021a110d647609282a1008127.png)
![\[ E_0 = \frac{m_e e^4}{2\hbar^2(4\pi\varepsilon_0)^2}.\]](/images/math/e/3/2/e3286e30266aeb2eb0d27f902ea46e8c.png)
![\[ E_n = -\frac{E_0}{n^2}-\frac{E_0}{2} \frac{\alpha_f^2}{n^4}+O\left[n^{-6}\right], \]](/images/math/1/9/9/199cedfdb000e94b97da397355f62e91.png)
![\[E_n^* = -\frac{E_0}{n^2},\]](/images/math/6/e/e/6ee9b65a150eb583861a491351b3a4f1.png)
![\[ E_0^* = \frac{E_0}{1+\textstyle \frac{m_e}{M}} \approx E_0 \left(1- \frac{m_e}{M}\right), \]](/images/math/3/c/f/3cfa608d96f63f174a55fb8b88a36a1c.png)
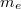 az elektron,
az elektron, ![\[\nu' \approx \frac{\nu}{1+\displaystyle \frac{h\nu}{Mc^2}},\]](/images/math/b/3/4/b3456225f815bfd0b26120dce20131a2.png)
 a visszalökődés nélküli foton frekvenciája,
a visszalökődés nélküli foton frekvenciája, 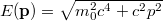 .
. ![\[ R(r) = A_n \left(\frac{r}{a_0}\right)^{n-1} e^{\textstyle -\frac{r}{n a_0}}.\]](/images/math/c/0/f/c0f960f3b75cc266fda2e137a4acc04b.png)
![\[r_\text{lv.}=n^2 a_0\]](/images/math/b/a/7/ba7a51917aa422072b054ff3f54a2da0.png)